But de l’étude : l’otite externe nécrosante (maligne) est une infection agressive du conduit auditif externe et de l’os temporal qui survient le plus souvent chez les patients âgés diabétiques.
S. Nouikes Zitouni, Faculté de Médecine d’Annaba, Service d’ORL et de Chirurgie Cervico-Faciale, CHU d’Annaba.
Date de soumission : 09 Juin 2020.
Résumé : But de l’étude : l’otite externe nécrosante (maligne) est une infection agressive du conduit auditif externe et de l’os temporal qui survient le plus souvent chez les patients âgés diabétiques. Nous avons examiné les cas d’otite externe maligne dans notre service pour étudier les caractéristiques épidémiologiques et cliniques de cette pathologie ainsi que les éléments de sa prise en charge. Méthodes : il s’agit d’une étude rétrospective observationnelle sur une période de 05 ans (2010-2014). Résultats : 17 patients étaient inclus. 10 femmes (58,8%) et 7 hommes (41,2%) avec un âge moyen de 75,4±10,09 ans. Le diabète était présent chez tous les patients. L’otalgie était le symptôme le plus courant. La sténose du conduit auditif externe était observée chez 13 patients. Six cas avaient une paralysie faciale à l’admission. Pseudomonas aeuroginosa était isolé dans 41,2% des cas. La guérison était obtenue chez 60% des patients. Conclusion : L’otite externe nécrosante (maligne) est une infection grave menaçant le pronostic vital. Il faut savoir y penser devant toute otite trainante chez un sujet diabétique ou immunodéprimé. Dans notre série nous déplorons la non-disponibilité de la TDM pour tous nos patients et de l’imagerie nucléaire qui restent fondamentales pour la prise en charge correcte de cette pathologie.
Mots clés : Otite externe maligne, Pseudomonas aeruginosa, diabète, quinolones, mortalité
Abstract: Aim of the study: necrotizing otitis externa (malignant) is an aggressive infection of the external ear canal and temporal bone that occurs most often in elderly diabetic patients. We have examined the cases of malignant otitis externa in our department to study the epidemiological and clinical characteristics of this pathology as well as the elements of its management. Methods: this is a retrospective observational study over a period of 05 years (2010-2014). Results: 17 patients were included. 10 women (58.8%) and 7 men (41.2%) with an average age of 75.4±10.09 years. Diabetes was present in all patients. Earache was the most common symptom. Stenosis of the external auditory canal was observed in 13 patients. Six cases had facial paralysis on admission. Pseudomonas aeuroginosa was isolated in 41.2% of cases. Healing was achieved in 60% of patients. Conclusion: necrotizing (malignant) otitis externa is a serious, life-threatening infection, and it is important to know how to think about it in the presence of any lingering otitis in a diabetic or immunocompromised person. In our series, we deplore the unavailability of CT for all patients and nuclear imaging, which remains fundamental for the correct management of this pathology.
Keywords: Malignant otitis externa, Pseudomonas aeruginosa, diabetes, quinolones, mortality.
Introduction
L’otite externe nécrosante (maligne) est une infection agressive du conduit auditif externe (CAE) et de l’os temporal qui survient le plus souvent chez les patients âgés diabétiques. Elle a été évoquée pour la première fois dans la littérature par Toulmouche en 1838 (1). En 1959, Meltzer et Kelemen ont identifié un cas d’ostéomyélite de l’os temporal due au Pseudomonas. L’otite externe maligne a été décrite et caractérisée comme une entité clinique par Chandler en 1968 qui publia une série de 13 patients (2). Le qualificatif de ‘’maligne’’ lui a été attribué en raison de l’agressivité de la maladie, du taux de mortalité élevé qui lui est associé, et de la mauvaise réponse au traitement. Ce terme ‘’maligne’’ devrait être abandonné et une description plus appropriée comme ‘’otite externe nécrosante’’ ou ‘’ostéomyélite de la base du crâne’’ devrait être adoptée (1,3).
Pseudomonas aeruginosa est le principal micro-organisme classiquement impliqué dans l’apparition de cette maladie. D’autres germes peuvent être en cause tels que le Staphylococcus aureus, en particulier le SARM (résistant à la méticilline), Staphylococci epidermidis, Proteus mirabilis, Klebsiella oxytoca et les champignons.
Le tableau clinique est dominé par une otalgie profonde persistante, une otorrhée purulente, une baisse de l’audition et des céphalées. Au stade avancé de la maladie, une paralysie des nerfs crâniens, une atteinte de l’articulation temporo-mandibulaire ou de l’espace parapharyngé peuvent survenir.
Initialement gérée chirurgicalement, l’otite externe nécrosante (OEN) peut désormais être traitée efficacement avec des antibiotiques, la chirurgie étant réservée à la biopsie et au débridement local (4).
L’objectif de la présente étude était d’évaluer la présentation clinique et la réponse au traitement chez les patients qui se sont présentés à notre service pour une OEN.
Matériels et méthodes
Nous avons conduit une étude rétrospective observationnelle sur une période de 05 ans (2010-2014) au service d’oto-rhino-laryngologie du CHU d’Annaba.
Le diagnostic était posé à l’admission du patient ou au cours de son hospitalisation. Pour chaque patient nous avons examiné les données suivantes :
- L’âge
- Le sexe
- Les antécédents
- Le délai de consultation depuis le début des symptômes
- Les symptômes
- Les données de l’examen clinique
- Les résultats des prélèvements bactériologiques
- Le bilan biologique : vitesse de sédimentation (VS), C-réactive protéine (CRP), formule numération sanguine (FNS), glycémie, bilan rénal
- L’imagerie : tomodensitométrie (TDM) de l’os temporal et/ou imagerie par résonnance magnétique (IRM)
- Le protocole thérapeutique
- La durée d’hospitalisation
- L’évolution.
L’évaluation de la paralysie faciale (PF) était effectuée selon la classification de House-Brackmann (5).
Le protocole de traitement dans notre service comporte une antibiothérapie : Ciprofloxacine, ou Ofloxacine par voie parentérale en monothérapie, ou en association avec une céphalosporine de troisième génération, ou un aminoside, associé à un antalgique. L’antibiothérapie est réajustée en fonction des résultats de l’antibiogramme, si besoin.
Le traitement local est systématique, il consiste en des aspirations quotidiennes, un calibrage du CAE par un POP Oto Wick et des instillations biquotidiennes d’une quinolone.
La réponse au traitement était basée sur la réduction de la douleur et l’amélioration des données otoscopiques à l’examen au microscope (diminution de l’œdème des parois du CAE, de la congestion et des granulations).
La sortie de l’hôpital était décidée selon les critères suivants :
- Disparition de la douleur
- Disparition de l’œdème du CAE
- Disparition de l’otorrhée
L’antibiothérapie était poursuivie par voie orale pendant au moins les deux semaines suivant la sortie.
Résultats
Un total de 17 patients était identifié, 10 femmes (58,8%) et 7 hommes (41,2%), avec un âge moyen de 75,4±10,09 ans (extrêmes : 24-87 ans). Les principales caractéristiques épidémiologiques et cliniques des patients sont présentées dans le tableau 1.
Un diabète mal équilibré a été retrouvé chez tous les malades, il était de type 1 dans 10 cas (58,8%) et de type 2 dans 7 cas (41,2%). Cinq patients avaient une hypertension artérielle, deux patients avaient une hypercholestérolémie et un autre une insuffisance rénale chronique terminale (IRCT).
Le délai diagnostique était de 10 semaines. Pendant cette période, tous les patients avaient pris des antibiotiques par voie orale, parmi lesquels amoxicilline + clavulanate, quinolones et des céphalosporines de 3ème génération associés parfois à des gouttes auriculaires à base d’antibiotiques avec ou sans corticostéroïdes. Ces traitements étaient prescrits par des omnipraticiens mais également des otorhinolaryngologistes.
Les facteurs déclenchant étaient des lésions de grattage dans deux cas, un traumatisme auriculaire dans un cas et une exérèse d’un polype de l’oreille moyenne dans un cas.
L’otalgie dominait le tableau clinique, retrouvée chez 16 patients, un patient n’avait pas de douleur au moment de l’admission. L’otorrhée purulente était présente chez 100% des patients de même que l’hypoacousie. Deux patients avaient des vertiges et un seul avait un prurit auriculaire.
La PF existait à l’admission chez 6 patients (35,3%). Elle était survenue au cours de l’hospitalisation dans un cas.
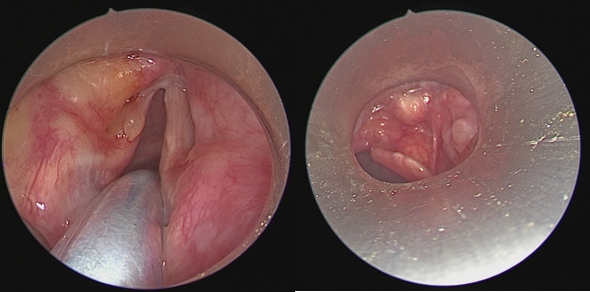
L’examen de l’oreille avait révélé une sténose totale du conduit dans 13 cas (76,5%), des granulations inflammatoires dans 9 cas (52,9%), une tuméfaction rouge de la région mastoïdienne était retrouvée chez un patient. Deux patients (11,8%) présentaient un empâtement de la région parotidienne.
Le Pseudomonas aeruginosa était isolé sur 7 prélèvements bactériologiques (41,2%) et le Staphylocoque aureus sur 2 (11,75%). Dans 8 cas (47,05%) la culture était négative.
Les paramètres biologiques de l’inflammation, lorsqu’ils étaient recherchés, avaient montré une accélération de la vitesse de sédimentation (supérieure à 50 mm la première heure), une augmentation de la C-réactive protéine (supérieure à 11mg / L) et une hyperleucocytose.
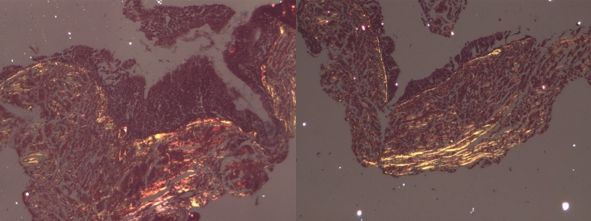
La biopsie du tissu de granulation du CAE était réalisée dans 6 cas. Le résultat histologique était en faveur d’un processus inflammatoire non spécifique.
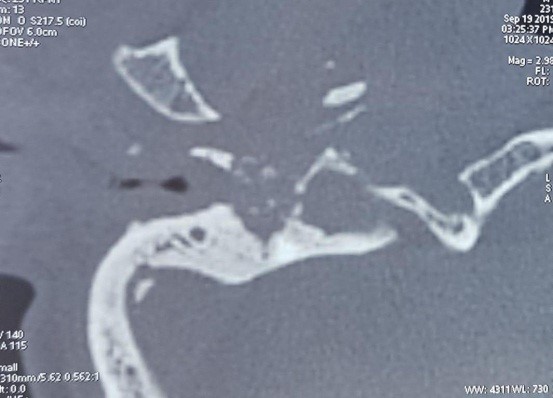
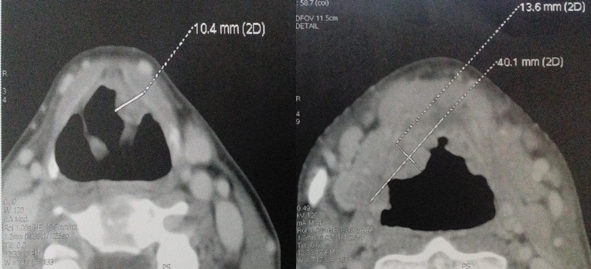
La TDM en coupes coronales et axiales en fenêtre parenchymateuse et osseuse de l’os temporal, réalisée dans 10 cas avait mis en évidence des signes de comblement tissulaire du CAE et de l’oreille moyenne chez tous les malades, associés à une ostéolyse dans 4 cas.
L’IRM était réalisée chez une seule patiente au début de la maladie et n’avait noté qu’un comblement tissulaire du CAE.
Le protocole thérapeutique, résumé dans le tableau 2, comporte une antibiothérapie par voie parentérale comprenant une Quinolone (Fluoroquinolone), seule dans 7 cas, associée à une céphalosporine de troisième génération dans 6 cas, et à un aminoside dans 4 autres. Dans tous les cas un traitement antalgique, une insulinothérapie et des soins auriculaires quotidiens étaient instaurés. Le traitement de la paralysie faciale consistait à administrer de la méthylprednisolone à une dose unique matinale de 1 mg/kg pendant 10 jours avec monitoring de la glycémie. Des soins ophtalmiques sont également administrés. Deux patients ont subi une mastoïdectomie.
La durée moyenne du traitement antibiotique par voie parentérale était égale à la durée d’hospitalisation qui était de 20,7±12,24 (7-62) jours. Deux patients étaient sortis contre avis médical l’un après 9 jours et l’autre après 10 jours d’hospitalisation. Trois patients étaient ré-adressés à leur structure d’origine après 6, 7 et 8 jours de traitement respectivement. Les malades étaient mis sortants sous traitement antibiotique per os.
Des contrôles réguliers étaient effectués jusqu’à guérison complète jugée uniquement sur les signes cliniques : disparition de l’otalgie, tarissement de l’otorrhée, normalisation du conduit.
L’évolution était marquée par la guérison dans 9 cas (60%). Nous avons observé des complications pendant la première semaine du traitement, dans 5 cas (3 cas de périchondrite, 1 cas d’abcès du cerveau et 1 cas de paralysie faciale). Parmi les 6 patients ayant présenté une PF, 3 patients avaient bien répondu au traitement avec une récupération complète de la PF.
Cependant, 2 patients présentant initialement une PF grade 4 n’avaient pas récupéré. Les deux patients, sortis contre avis médical, étaient perdus de vue. Un patient avait présenté une récidive d’OEN, six mois après guérison.
Nous déplorons un décès, celui d’une patiente qui était âgée de 67 ans, admise avec une PF grade V et qui avait présenté un abcès du cerveau avec une ostéomyélite étendue de la base du crâne.
Discussion
L’OEN est une infection grave associée à une grande morbimortalité. Avant l’ère des antibiotiques efficaces contre le Pseudomonas aeruginosa, le traitement était essentiellement chirurgical et la mortalité avoisinait les 50% (6). Non diagnostiquée ou partiellement traitée, l’OEN peut se propager progressivement à la base du crâne et provoquer des complications majeures telles que la thrombose du sinus latéral ou de la veine jugulaire interne, la méningite, l’abcès de Bezold et la paralysie des nerfs crâniens (7-9).
Le diabète est le premier facteur, qu’on retrouve dans la littérature, favorisant l’infection, cependant très peu de preuves scientifiques soutiennent cette idée (1). Plusieurs hypothèses physiopathologiques ont tenté d’expliquer la survenue de cette infection, parmi elles le déficit immunitaire médié par les polynucléaires neutrophiles, la vascularite induite par les germes pathogènes et favorisée par la microangiopathie diabétique ainsi que l’élévation du PH du conduit auditif externe, ce qui favorise l’agression microbienne. Cette condition a été retrouvée chez tous nos patients au même titre que la majorité des séries de la littérature.
L’OEN peut également survenir chez les sujets non diabétiques immunodéprimés, présentant une tumeur maligne, sous chimiothérapie, dénutris ou sous fortes doses de corticostéroïdes (10).
Dans notre série, nous avons retrouvé un facteur déclenchant dans 23,5% des cas. La majorité des cas d’OEN étaient observés pendant les mois chauds et humides soulignant ainsi le rôle du climat dans l’éclosion de cette pathologie. Rubin a trouvé un facteur déclenchant dans 60% des cas, principalement un traumatisme du CAE (exérèse d’un bouchon de cérumen, aide auditive) et a également souligné l’importance du climat dans cette entité de la même façon que dans l’otite du baigneur (11).
Nos patients se sont présentés après 10 semaines (moyenne) d’otalgie. Ce retard dans le diagnostic est probablement dû au diagnostic erroné d’otite externe diffuse banale, non nécrosante, qui est généralement le premier diagnostic.
Bien que divers auteurs aient proposé des critères diagnostiques (4,12,13) ; il n’existe à ce jour aucun organigramme diagnostique consensuel. Les critères de Levenson peuvent être utilisés pour le diagnostic, ils regroupent les éléments suivant : otite externe réfractaire, otalgie nocturne sévère et otorrhée purulente. Ces signes sont associés à une infection à Pseudomonas, et à un tissu de granulation chez un patient immunodéprimé ou diabétique. La paralysie faciale, les troubles de la déglutition et la dysphonie peuvent survenir si les nerfs crâniens sont impliqués (14,15).
Nous avons enregistré un faible taux (52,9%) de cultures positives. Ceci peut être dû à la technique de culture et/ou à l’utilisation systématique d’une antibiothérapie locale (quinolone), qui peut entrainer des résultats de culture négatifs ou contaminés.
Le germe le plus fréquemment isolé dans notre étude était Pseudomonas aeruginosa suivi du Staphylococcus aureus.
Pseudomonas aeruginosa est l’organisme le plus communément isolé dans la littérature. D’autres bactéries telles que Staphylococcus aureus, S. epidermidis, Proteus mirabilis, Klebsiella oxytoca ont été incriminées dans l’OEN.
La tomodensitométrie (TDM) est utile pour identifier l’extension dans les tissus mous au-delà du CAE et l’atteinte osseuse précoce. L’imagerie par résonance magnétique (IRM) est plus efficace pour déterminer l’étendue de l’infection, et est essentielle en cas d’extension intracrânienne de la maladie. La place de l’imagerie nucléaire dans le diagnostic et le suivi des OEN est actuellement bien établie. La tomodensitométrie au Gallium 67 et la tomographie par émission de positons (PET scan) au 18 FDG, fournissent des informations diagnostiques plus spécifiques concernant la présence ou l’absence d’infection et constituent pour certains centres des gold-standards pour le diagnostic, la surveillance de l’évolution des OEN et la détermination de la durée du traitement antibiotique (14-16).
Dans notre série, la TDM était réalisée uniquement dans 58,8% des cas, en raison de sa non-disponibilité constante dans notre hôpital. Elle avait objectivé des signes d’ostéolyse avancée témoignant de l’agressivité du processus infectieux. L’imagerie nucléaire n’avait pas du tout été demandée, car le CHU d’Annaba n’en disposait pas et l’examen est très couteux dans les centres d’imagerie particuliers.
Figure 1 : TDM en coupe axiale objectivant une importante ostéomyélite de la base du crâne.
Le traitement de l’OEN est un véritable challenge pour le chirurgien car il n’existe pas de recommandations internationales pour la prise en charge de cette pathologie (7,10,12,15,17). Néanmoins, les auteurs s’accordent sur l’intérêt du contrôle du diabète, de la correction des électrolytes et de l’état nutritionnel du patient dans le protocole thérapeutique.
Il existe plusieurs schéma thérapeutiques, la plupart des auteurs combinent une céphalosporine de troisième génération avec une fluoroquinolone pour éviter les résistances (19–22). D’autres utilisent l’association de la pénicilline semi-synthétique avec un aminoglycoside, mais sa toxicité potentielle recommande son utilisation uniquement en cas de multirésistance à l’antibiogramme. Certains auteurs préconisent une monothérapie (céphalosporine de troisième génération ou fluoroquinolones) avec d’excellents résultats surtout dans les formes limitées d’OEN. La durée du traitement intraveineux varie de 4 à 6 semaines. La suspension du traitement nécessite une surveillance régulière jusqu’à la récupération clinique complète et la normalisation de la scintigraphie Galium-67 (1,7,8,13,15,21,23–25). Dans notre expérience et en raison de l’absence des moyens de surveillance (imagerie nucléaire), le traitement antibiotique était poursuivi par voie orale après la sortie du patient jusqu’à deux semaines suivant la normalisation de l’otoscopie.
L’usage des antibiotiques locaux fait partie du protocole thérapeutique de notre service. Leur utilisation est controversée. Certains auteurs affirment que ces préparations modifient la flore bactérienne du CAE, diminuent le taux de cultures positives et créent une résistance aux antibiotiques sans valeur ajoutée aucune (6).
Actuellement le rôle de la chirurgie dans le traitement de l’OEN est très limité. Il se réduit au débridement du matériel nécrotique ou à la biopsie du tissu de granulation. Le recours à la mastoidectomie peut être nécessaire dans les cas graves pour l’exérèse de séquestres osseux afin de soulager le malade (26,27).
Conclusion
L’otite externe nécrosante (maligne) est une infection grave menaçant le pronostic vital. Il faut savoir y penser devant toute otite trainante chez un sujet diabétique ou immunodéprimé. Un diagnostic précoce et un traitement agressif sont les seuls garants d’une évolution favorable. La prévention doit passer obligatoirement par des mesures d’hygiène rigoureuses de l’oreille diabétique. Dans notre série nous déplorons la non-disponibilité de la TDM pour tous nos patients et de l’imagerie nucléaire qui restent fondamentales pour la prise en charge correcte de cette pathologie.
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts.
Bibliographie
- Vincent N, Mahdyoun P, Pulcini C, Raffaelli C, Castillo L, Guevara N. Pathologies acquises de l’oreille externe. Pathologiesacquisesdel’oreilleexterne.EMC-Oto-rhino-laryngologie2015;10(1):1-17.
- Chandler JR. Malignant external otitis. The Laryngoscope. août 1968;78(8):1257‑
- Saravanam P. Malignant Otitis Externa-A Review. J Infect Dis Ther. 28 févr 2015; Kumar SP, Singh U (2015) Malignant Otitis Externa-A Review. J Infect Dis Ther 3:204. doi: 10.4172/2332-0877.1000204.
- Rubin Grandis J, Branstetter BF, Yu VL. The changing face of malignant (necrotising) external otitis: clinical, radiological, and anatomic correlations. Lancet Infect Dis. janv 2004;4(1):34‑
- House JW, Brackmann DE. Facial nerve grading system. Otolaryngol-Head Neck Surg Off J Am Acad Otolaryngol-Head Neck Surg. avr 1985;93(2):146‑
- Glikson E, Sagiv D, Wolf M, Shapira Y. Necrotizing otitis externa: diagnosis, treatment, and outcome in a case series. Diagn Microbiol Infect Dis. janv 2017;87(1):74‑
- Bhat V, Aziz A, Bhandary SK, Aroor R, Kamath P SD, Saldanha M. Malignant Otitis Externa – A Retrospective Study of 15 Patients Treated in a Tertiary Healthcare Center. J Int Adv Otol. avr 2015;11(1):72‑
- Bhasker D, Hartley A, Agada F. Is malignant otitis externa on the increase? A retrospective review of cases. Ear Nose Throat J. févr 2017;96(2): E1‑
- Chen C-N, Chen Y-S, Yeh T-H, Hsu C-J, Tseng F-Y. Outcomes of malignant external otitis: survival vs mortality. Acta Otolaryngol (Stockh). 2010;130(1):89‑
- Sardesai RB, Krishnakumar T. Malignant otitis external-our experience. Indian J Otolaryngol Head Neck Surg. avr 2002;54(2):132‑
- Rubin J, Yu VL, Kamerer DB, Wagener M. Aural irrigation with water: a potential pathogenic mechanism for inducing malignant external otitis? Ann Otol Rhinol Laryngol. févr 1990;99(2 Pt 1):117‑
- Soudry E, Joshua BZ, Sulkes J, Nageris BI. Characteristics and prognosis of malignant external otitis with facial paralysis. Arch Otolaryngol Head Neck Surg. oct 2007;133(10):1002‑
- Guevara N, Mahdyoun P, Pulcini C, Raffaelli C, Gahide I, Castillo L. Initial management of necrotizing external otitis: errors to avoid. Eur Ann Otorhinolaryngol Head Neck Dis. juin 2013;130(3):115‑
- Illing E, Zolotar M, Ross E, Olaleye O, Molony N. Malignant otitis externa with skull base osteomyelitis. J Surg Case Rep. 1 mai 2011;2011(5):6.
- Shamanna K, Ganga VB. Changing Trends in the Management of Malignant Otitis Externa: Our Experience. Res Otolaryngol. 2018;7(1):9‑
- Ozgen B, Oguz KK, Cila A. Diffusion MR Imaging Features of Skull Base Osteomyelitis Compared with Skull Base Malignancy. Am J Neuroradiol. 1 janv 2011;32(1):179‑
- Shavit S, Bernstine H, Sopov V, Nageris B, Hilly O. FDG‐PET/CT for diagnosis and follow‐up of necrotizing (malignant) external otitis. The Laryngoscope. 1 déc 2018;129.
- Morales R, Eisenman D, Raghavan P. Imaging Necrotizing Otitis Externa. Semin Roentgenol. 1 avr 2019;54.
- Pérez P, Ferrer MJ, Bermell A, Ramírez R, Saiz V, Gisbert J. Malignant otitis externa. Our experience. Acta Otorrinolaringol Engl Ed. 1 janv 2010;61(6):437‑
- Bernstein JM, Holland NJ, Porter GC, Maw AR. Resistance of Pseudomonas to ciprofloxacin: implications for the treatment of malignant otitis externa. J Laryngol Otol. févr 2007;121(2):118‑
- Berenholz L, Katzenell U, Harell M. Evolving resistant pseudomonas to ciprofloxacin in malignant otitis externa. The Laryngoscope. sept 2002;112(9):1619‑
- Franco-Vidal V, Blanchet H, Bebear C, Dutronc H, Darrouzet V. Necrotizing external otitis: a report of 46 cases. Otol Neurotol Off Publ Am Otol Soc Am Neurotol Soc Eur Acad Otol Neurotol. Sept 2007;28(6):771‑
- Chawdhary G, Pankhania M, Douglas S, Bottrill I. Current management of necrotising otitis externa in the UK: survey of 221 UK otolaryngologists. Acta Otolaryngol (Stockh). août 2017;137(8):818‑
- Nikiforova GN, Svistushkin VM, Shevchik AE, Zolotova AV. [Malignant externa otitis: the modern principles of diagnostics and treatment]. Vestn Otorinolaringol. 2017;82(1):11‑
- Fang CH, Sun J, Jyung RW. Malignant otitis externa. Ear Nose Throat J. 4 mai 2015;94(4‑5):136‑
- Handzel O, Halperin D. Necrotizing (Malignant) External Otitis. Am Fam Physician. 15 juill 2003;68(2):309‑
- Singh J, Bhardwaj B. The Role of Surgical Debridement in Cases of Refractory Malignant Otitis Externa. Indian J Otolaryngol Head Neck Surg. 1 déc 2018;70(4):549‑
Tableau 1 : Données épidémiologiques, cliniques et microbiologiques des 17 patients traités pour une OEN au service ORL d’Annaba.
|
Age au moment du diagnostic |
§ 75,4±10,09 ans |
|
Sex-ratio |
§ 7/10 |
|
Antécédents |
§ Diabète type 1 11/17 (64,7%) § Diabète type 2 6/17 (39,3%) § HTA 5/17 (29,1%) § IRCT 1/17 (5,8%) |
|
Délais de consultation |
§ 10 semaines |
|
Symptômes |
§ Otalgie 16/17 § Otorrhée 17/17 § Prurit 1/17 § Hypoacousie 17/17 § Vertige 2/17 § Paralysie faciale 6/17 |
|
Résultats de l’examen clinique |
§ Fièvre 0/17 § Sténose du CAE 13/17 (76,5%) § Granulations du CAE 9/17 § Tuméfaction de la région mastoidienne1/17 § Empâtement de la région parotidienne 2/17 § PF 6/17 (35,3%), Grade III 3/6, Grade IV 2/6 § Grade V 1/6 |
|
Examens biologiques |
§ VS >50mm (1èreheure) § CRP > 11mg/L § Leucocytes > 10 000 /mm³ 11/17 (64,7%) |
|
Germes isolées sur les prélèvements auriculaires |
§ Pseudomonas aeruginosa 7/17 (41,2%) § Staphylococcus aureus 2/17 (11,75%) § Culture négative 8/17 (47,05%) |
|
Biopsie des granulations |
§ 6/9 § Histopathologie : processus inflammatoire non spécifique |
Tableau 2 : Données thérapeutiques et évolution.
|
Protocole thérapeutique |
§ Quinolone IV + traitement local 7/17 (41,2%) § Quinolone + Céphalosporine 3ème génération) IV + traitement local 6/17 (35,3%) § (Quinolone + Aminoside) IV + traitement local 4/17 (23,5%) |
|
Durée moyenne d’hospitalisation |
§ 20,7 ± 12,24 jours |
|
Évolution/Complications |
§ Perdus de vue 2/17 § Guérison 9/15 (60%) § Périchondrite 3/15 § Abcès cérébral 1/15 § Paralysie faciale 1/15 § Décès 1/15 |