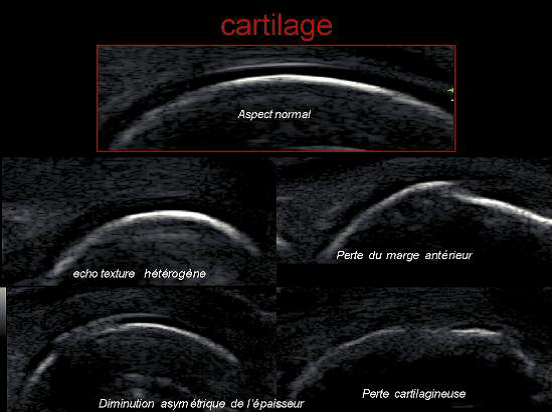
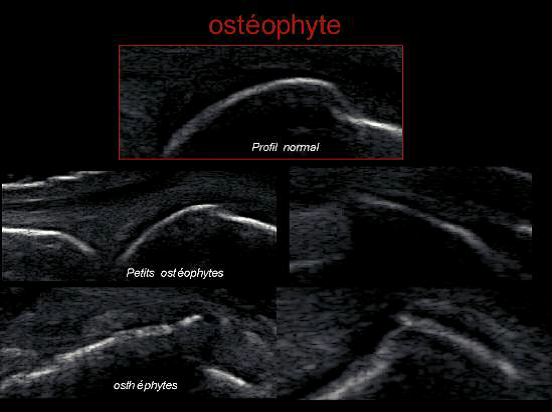
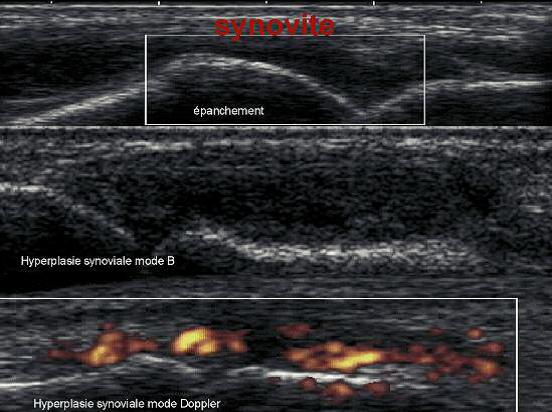
L’arthrose est la maladie ostéo-articulaire la plus fréquente, et est associée à une surmortalité liée au handicap fonctionnel dont elle est responsable. On définit cliniquement trois grands phénotypes cliniques d’arthrose basés sur ses principaux facteurs de risque : arthrose post-traumatique, arthrose métabolique – incluant l’arthrose liée à l’obésité – et arthrose liée au vieillissement.
S. Lehtihet, C. Haouichat, Service de Rhumatologie, CHU Djilali Bounaâma, Douéra, Alger
Date de soumission : 24 Juin 2020.
Résumé : L’arthrose est la maladie ostéo-articulaire la plus fréquente, et est associée à une surmortalité liée au handicap fonctionnel dont elle est responsable. On définit cliniquement trois grands phénotypes cliniques d’arthrose basés sur ses principaux facteurs de risque : arthrose post-traumatique, arthrose métabolique – incluant l’arthrose liée à l’obésité – et arthrose liée au vieillissement. L’arthrose associée au syndrome métabolique (SM) est un phénotype clinique défini par ses facteurs de risque (obésité et syndrome métabolique), et qui se caractérise par une inflammation de bas grade chronique. Le syndrome métabolique augmente le risque d’arthrose avec, à la fois un effet cumulatif des maladies métaboliques mais aussi un rôle indépendant et propre de chaque maladie métabolique (diabète, dyslipidémie ou hypertension artérielle). Au-delà du rôle du stress mécanique lié à l’excès de poids, de nombreux mécanismes physiopathologiques sont impliqués, parmi eux, on peut citer l’inflammation de bas grade secondaire à la production endocrine de médiateurs pro-inflammatoires du tissu adipeux des sujets obèses (adipokines), le stress oxydant induit par l’hyperglycémie chronique, l’insulinorésistance des tissus articulaires chez les patients diabétiques ou encore le rôle délétère sur l’articulation des LDL-oxydés. Enfin, les sujets arthrosiques ont une surmortalité d’origine cardiovasculaire qui semble être à la fois une conséquence de l’association avec les maladies métaboliques et de la sédentarité secondaire à l’arthrose.
Mots-clés : Syndrome métabolique, arthrose, inflammation.
Abstract: Osteoarthritis (OA) is the most common osteoarticular disease associated with excess mortality linked to the functional disability for which it is responsible. We clinically define three major clinical phenotypes of OA based on its main risk factors: post-traumatic osteoarthritis, metabolic OA including OA linked to obesity and arthritis linked to aging. OA associated with metabolic syndrome is a clinical phenotype defined by its risk factors (obesity and metabolic syndrome) and which is characterized by chronic low-grade inflammation. Metabolic syndrome increases the risk of OA with both a cumulative effect of metabolic diseases but also an independent and specific role for each metabolic disease (diabetes, dyslipidaemia or high blood pressure). Beyond the role of mechanical stress linked to excess weight, many pathophysiological mechanisms are involved, among them, we can mention low grade inflammation secondary to the endocrine production of pro-inflammatory mediators of the fatty tissue of the subjects obese (adipokines), oxidative stress induced by chronic hyperglycaemia, insulin resistance of joint tissues in diabetic patients or even the deleterious role on the LDL-oxidized joint. Finally, people with osteoarthritis have excess cardiovascular mortality, which seems to be both a consequence of the association with metabolic diseases and a sedentary lifestyle secondary to OA. Finally, primary prevention and management of obesity and metabolic syndrome could help slow the onset and progression of osteoarthritis.
Key words: osteoarthritis, metabolic syndrome, Inflammation.
Introduction
L’arthrose est la première cause de maladie ostéo-articulaire et l’une des principales causes de handicap après 65 ans. Son incidence ne cesse de croître du fait du vieillissement de la population et de la prévalence de l’obésité, constituant ainsi un enjeu médico-économique. Longtemps considérée comme banale, du point de vue du médecin, l’arthrose occupe actuellement une place majeure en recherche dans les maladies ostéo-articulaires, justifiée par son épidémiologie croissante.
Rôles des troubles métaboliques dans la physiopathologie de l’arthrose
L’arthrose est une maladie ostéo-articulaire d’origine plurifactorielle : génétique, traumatique, sénescente et/ou métabolique. Ainsi, en fonction des facteurs de risque impliqués, on distingue des phénotypes cliniques d’arthrose ayant des mécanismes physiopathologiques distincts. Parmi eux, on compte principalement l’arthrose post-traumatique, l’arthrose liée au vieillissement et l’arthrose métabolique.
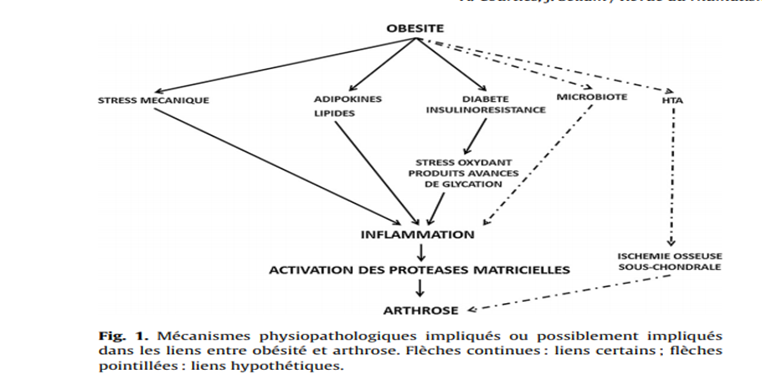
L’inflammation est reconnue comme un phénomène clé dans la physiopathogénie de l’arthrose, lié à l’activation du métabolisme chondrocytaire, elle-même induite et dirigée par la sécrétion de diverses cytokines (IL-1, IL-6, etc.), de médiateurs lipidiques (prostaglandines, leucotriènes) et de dérivés de l’oxygène, tels que le monoxyde d’azote (NO). L’activation chondrocytaire est, pour partie, autocrine, mais résulte également d’une communication paracrine avec les tissus environnants. En effet, la membrane synoviale arthrosique est le siège d’infiltrats inflammatoires constitués de macrophages et de lymphocytes qui concourent à la production de nombreux médiateurs inflammatoires qui vont contribuer à cette activation chondrocytaire. L’os sous-chondral influence également le métabolisme cartilagineux grâce à des interactions à la fois biomécaniques et biochimiques (1).
Outre les phénomènes inflammatoires locaux, l’arthrose s’associe à une inflammation systémique de bas grade, comme l’attestent les études ayant mesuré les médiateurs inflammatoires sériques chez les sujets arthrosiques comparativement aux sujets sains (2). Le syndrome métabolique se caractérise également par une inflammation systémique de bas grade liée à une libération excessive de médiateurs inflammatoires tels que l’interleukine (IL) 6 ou le Tumor Necrosis Factor alpha (TNF-α) et d’adipokines comme la leptine par les tissus adipeux (TA), notamment le TA viscéral (TAV), qui est aussi le principal tissu impliqué dans l’insulinorésistance à l’origine du SM. L’hypothèse qui en découle est que cette inflammation chronique présente au cours du SM pourrait ainsi influencer le métabolisme des différents tissus de l’articulation, et ainsi favoriser la survenue des atteintes arthrosiques. Néanmoins, d’autres mécanismes semblent être incriminés dans l’association entre SM et arthrose. C’est le cas du stress oxydatif, qui est associé à l’insulinorésistance et à la dégradation du cartilage (3).
D’où le concept d’arthrose métabolique
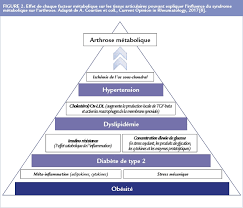
L’arthrose métabolique englobe à la fois l’arthrose induite par l’obésité mais aussi l’arthrose associée au syndrome métabolique, même si la définition exacte de ce syndrome reste discutée (4) (Figure 2). Il est facile de comprendre que l’obésité favorise la survenue d’arthrose des membres inférieurs par l’excès de stress mécanique appliqué aux articulations portantes. De manière inattendue, le surpoids et l’obésité sont associés à un doublement du risque d’arthrose digitale, alors que ces articulations ne sont pas soumises à l’excès de contraintes liées au poids. Cette donnée a mis en avant le rôle de facteurs systémiques (adipokines, cytokines pro-inflammatoires), mais une vision encore plus ‘’systémique’’ peut être envisagée : en effet, au-delà de l’obésité, le syndrome métabolique est aussi associé à une augmentation du risque d’arthrose (Figure 2). Tout d’abord, au sein de la population générale, la prévalence du syndrome métabolique est augmentée dans la population arthrosique par rapport à celle non-arthrosique de même âge (59% versus 23%). De plus, l’accumulation des facteurs métaboliques (hypertension, diabète, dyslipidémie) augmente le risque d’arthrose, indépendamment du poids.
- Définition du syndrome métabolique
Le syndrome métabolique a été décrit pour la première fois par G.M. Reaven en 1988, sous le nom de syndrome X (5). Il se caractérise par une insulinorésistance, et associe dans sa forme complète une hypertension artérielle (HTA), une intolérance glucidique, une dyslipidémie (élévation des triglycérides et/ou taux faible de cholestérol lié aux lipoprotéines de haute densité [HDL-c]) et une obésité androïde. Pour éviter une variabilité de la définition des facteurs métaboliques et du syndrome métabolique entre les études, les experts internationaux ont tenté une harmonisation des critères et ont retenu, en 2009, des seuils différents de tour de taille en fonction des pays et/ou des ethnies (6). Ces critères sont énumérés dans le tableau 1.
Figure 1 : Effet de chaque facteur métabolique sur les tissus articulaires pouvant expliquer l’influence du syndrome métabolique sur l’arthrose.
Adapté de A. Courties et coll., Current Opinion in Rheumatology, 2017 [8].
- Épidémiologie du syndrome métabolique
En 2003, une étude de cohorte française (cohorte DESIR) a montré une prévalence standardisée sur l’âge du syndrome métabolique de 15% chez les hommes et de 10% chez les femmes (7). Elle augmentait avec l’âge. Ainsi, en France, celle-ci était de 7,6% chez les hommes de moins de 40 ans et de 4,3% chez les femmes de même âge, tandis qu’elle s’élevait, respectivement à 33,8% et 28,5% entre 60 et 65 ans. Par ailleurs, le syndrome métabolique est un facteur de risque important de survenue de pathologies cardiovasculaires en général (risque relatif [RR] de 2,18), de pathologies coronariennes (RR=1,65), et de décès en rapport avec une maladie cardiovasculaire (RR=1,91) [8].
- Liens épidémiologiques entre arthrose et syndrome métabolique
Plusieurs études transversales se sont attachées à rechercher un lien entre arthrose et syndrome métabolique, la majorité ayant centré leurs travaux sur la gonarthrose. Sowers et al., ont démontré, dans l’étude d’une cohorte de 482 femmes, que la présence d’une “atteinte métabolique” (définie par l’existence d’au moins 2 facteurs métaboliques), en association avec l’obésité, majorait la probabilité d’avoir une gonarthrose radiographique (odds-ratio [OR]=3 [1,03-8,71] pour l’obésité seule, et OR=6,20 [2,93-13,07] pour l’association obésité / “atteinte métabolique”) [9]. Puenpatom et al., à partir des données issues de l’enquête nord-américaine NHANES III, ont mis en évidence une association significative entre arthrose et syndrome métabolique, ce dernier étant retrouvé deux fois plus souvent dans le groupe de patients arthrosiques. L’échantillon de la population générale comprenait 7.714 sujets, dont 975 sujets avaient l’arthrose et 6.739 n’en avaient pas. Le syndrome métabolique était répandu dans 59% de la population arthrosique et 23% de la population sans arthrose. Chacun des 5 facteurs de risque cardiovasculaire qui composent le syndrome métabolique était plus répandu dans la population arthrosique que dans la population sans arthrose : hypertension (75% vs 38%), obésité abdominale (63% vs 38%), hyperglycémie (30% vs 13%) , triglycérides élevés (47% vs 32%) et cholestérol des lipoprotéines de haute densité faible (44% vs 38%). Le syndrome métabolique était plus répandu chez les sujets atteints d’arthrose quel que soit le sexe ou la race. L’association entre arthrose et syndrome métabolique était plus importante chez les sujets plus jeunes et diminuait avec l’âge (10). Une étude algérienne multicentrique réalisée en 2014 chez 415 patients âgés en moyenne de 67 ans, présentant une gonarthrose, a retrouvé un syndrome métabolique chez 83,4% des patients (11). Outre ces études transversales, des études longitudinales de cohorte, ont permis de mieux définir la nature exacte des liens unissant la gonarthrose et les désordres métaboliques. Ainsi, l’association entre syndrome métabolique et arthrose a été évaluée dans une cohorte suédoise regroupant 5.171 participants au cours de 12 années de suivi. Parmi les patients avec arthrose, 39,3% avaient un syndrome métabolique contre seulement 21,9% chez ceux indemnes d’arthrose sévère (12). L’étude de Hussain et al., à partir de la cohorte de Melbourne ayant inclus 20.430 patients suivis entre 2003-2007 et 2011, a montré que l’incidence de gonarthrose sévère était significativement associée à la présence d’un syndrome métabolique, et qu’elle augmentait en fonction du nombre de facteurs métaboliques présents [13]. L’étude ROAD (population dans un district au Japon), s’est intéressée à l’association entre l’incidence de la gonarthrose radiologique et les différents éléments du syndrome métabolique chez 1.384 participants suivis sur 3 ans (14). Les auteurs ont mis en évidence que l’intolérance glucidique ainsi que l’HTA, étaient positivement associées à la survenue d’une gonarthrose radiologique avec des OR respectifs de 1,94 (p=0,03) et 2,74 (p=0,008). Enfin, la présence d’un seul des éléments du syndrome métabolique induisait un risque 2,3 fois supérieur de développer une arthrose de genou et l’existence d’au moins 3 facteurs, un risque 9,8 fois supérieur.
Conclusion
Le concept d’arthrose métabolique a ouvert la possibilité de prévenir l’arthrose. Si le vieillissement est inéluctable, la prévention de l’obésité et du syndrome métabolique pourrait influencer l’incidence et la progression de l’arthrose.
Un dépistage systématique du syndrome métabolique chez les sujets jeunes présentant une arthrose est recommandé. Il faut surtout sensibiliser les rhumatologues à dépister le syndrome métabolique chez tous les sujets obèses dans une filière de soins pour gonarthrose.
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- Suri S, Walsh DA. Osteochondral alterations in osteoarthritis. Bone 2012; 51:204-11.
- Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!). Osteoarthritis Cartilage 2013; 21:16-21.
- Zhuo Q, Yang W, Chen J, Wang Y. Metabolic syndrome meets osteoarthritis. Nat Rev Rheumatol 2012;8: 729-37.
- Courties A, Gualillo O, Berenbaum F, Sellam J. Metabolic stress-induced joint inflammation and osteoarthritis. Osteoarthr Cartil 2015; 23:1955–65. doi: 10.1016/j.joca.
- Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 1988; 37:1595-607
- Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation2009; 120:1640-5.
- Balkau B, Vernay M, Mhamdi L et al.; D.E.S.I.R. Study Group. The incidence and persistence of the NCEP (National Cholesterol Education Program) metabolic syndrome. The French D.E.S.I.R. study. Diabetes Metab 2003;29: 526-32.
- Gami AS, Witt BJ, Howard DE et al. Metabolic syndrome and risk of incident cardiovascular events and death: a systematic review and meta-analysis of longitudinal studies. J Am CollCardiol2007; 49:403-14.
- Sowers M, Karvonen-Gutierrez CA, Palmieri-Smith R, Jacobson JA, Jiang Y, Ashton-Miller JA. Knee osteoarthritis in obese women with cardiometabolic clustering. Arthritis Rheum 2009; 61:1328-36.
- Puenpatom RA, Victor TW. Increased prevalence of metabolic syndrome in individuals with osteoarthritis: an analysis of NHANES III data. Postgrad Med 2009; 121:9-20.
- Haouichat, FZ. Bouzid, F. Kerri, SE. Kaddem, S. Slimani, T. Khaled, H. Ayed, S. Heni, H. Djoudi, “Prévalence des comorbidités chez les patients algériens atteints d’arthrose des genoux et ou des mains suivis en consultation: étude multicentrique. Revue du Rhum 81S (2014) A129-A387.
- Engström G, Gerhardsson de Verdier M, Rollof J, Nilsson PM, Lohmander LS. C-reactive protein, metabolic syndrome and incidence of severe hip and knee osteoarthritis. A population-based cohort study. Osteoarthritis Cartilage 2009; 17:168-73.
- Monira Hussain S, Wang Y, Cicuttini FM et al. Incidence of total knee and hip replacement for osteoarthritis in relation to the metabolic syndrome and its components: a prospective cohort study. Semin Arthritis Rheum 2013;43: 429-36.
- Yoshimura N, Muraki S, Oka H et al. Accumulation of metabolic risk factors such as overweight, hypertension, dyslipidaemia, and impaired glucose tolerance raises the risk of occurrence and progression of knee osteoarthritis: a 3-year follow-up of the ROAD study. Osteoarthritis Cartilage 2012; 20:1217-26.
Tableau 1. Critères diagnostiques de syndrome métabolique (6).
|
Critères de diagnostic |
Consensus (2009) Au moins 3 critères sur 5 (Obésité abdominale non requise) |
|
Obésité abdominale |
Tour de taille (Variable en fonction des ethnies) 1/ Sujets européens, africains – Homme : ≥ 94 cm – Femme : ≥ 80 cm 2/ Sujets nord-américains – Homme : ≥ 102 cm – Femme : ≥ 88 cm 3/ Sujets sud-asiatiques et chinois – Homme : ≥ 90 cm – Femme : ≥ 80 cm 4/ Sujets japonais – Homme : ≥ 85 cm – Femme : ≥ 90 cm |
|
Élévation des triglycérides
|
≥ 1,7 mmol/l (150 mg/dl) ou Traitement de la dyslipidémie |
|
Diminution du taux de HDL-c
|
Homme : < 1,0 mmol/l ou 40 mg/dl Femme : < 1,3 mmol/l ou 50 mg/dl ou Traitement de la dyslipidémie |
|
Intolérance glucidique
|
Glycémie à jeun ≥ 1 g/l ou Traitement antidiabétique |
|
HTA |
≥ 135/85 mm Hg ou Traitement antihypertenseur |