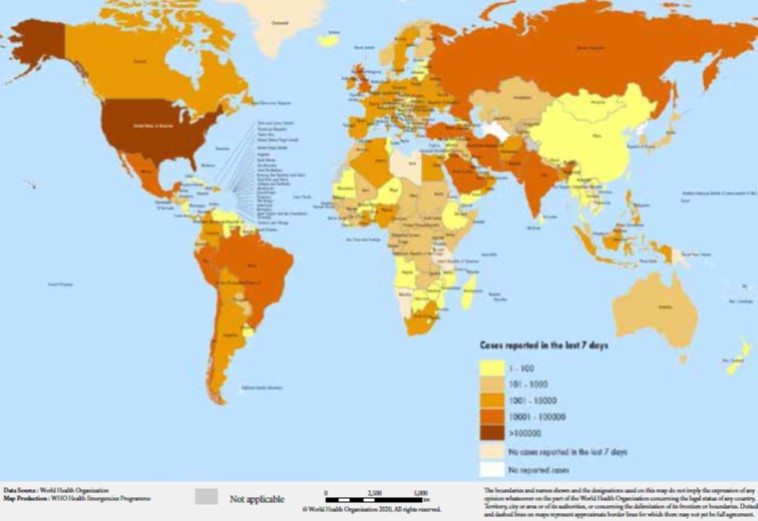
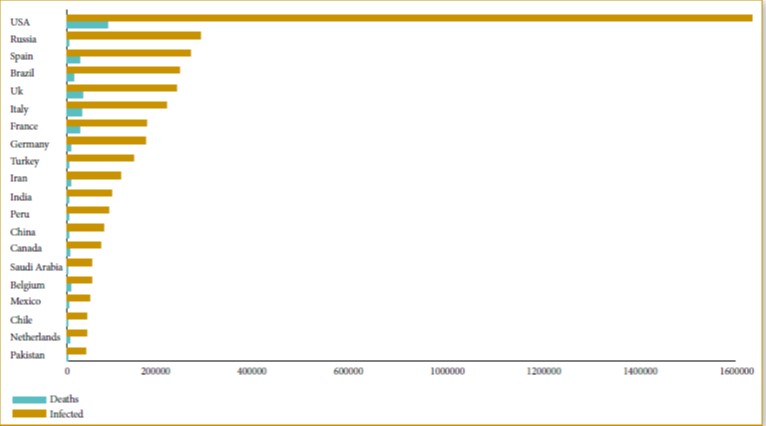
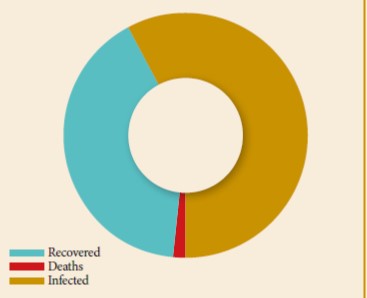
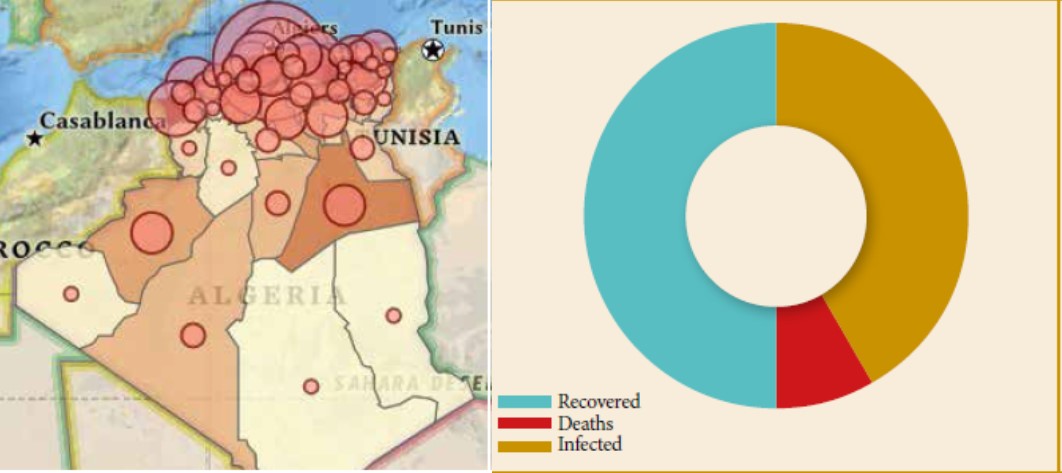
LL’actuelle pandémie de Covid-19 connait depuis son émergence une diffusion très rapide depuis plusieurs mois. Tous les pays sont touchés, avec un nombre de cas qui dépasse à ce jour les 4.000.000, 282.000 décès et 1,4 million de guérisons. En Algérie, les cas confirmés à ce jour (10 mai 2020), avoisinent les 5.723 cas, dont 502 décès et 2.678 guérisons.
Achour, A. Saaddjaballah, S. Chadi, K. Zemoulia, T. Benouali, S. Assasi, R. Fellah, H. Boulghala, F. Toumi, Service B, Maladies Infectieuses, EHS El Hadi Flici (ex El Kettar)
Date de soumission : 11 Mai 2020.
Résumé : L’actuelle pandémie de Covid-19 connait depuis son émergence une diffusion très rapide depuis plusieurs mois. Tous les pays sont touchés, avec un nombre de cas qui dépasse à ce jour les 4.000.000, 282.000 décès et 1,4 million de guérisons. En Algérie, les cas confirmés à ce jour (10 mai 2020), avoisinent les 5.723 cas, dont 502 décès et 2.678 guérisons. La cinétique de l’épidémie semble ralentir, grâce en particulier aux mesures barrières et de confinement. Un optimisme prudent se profile, avec toujours la crainte d’une seconde vague épidémique. Les cas de Covid-19 sont diagnostiqués et pris en charge selon des critères de probabilité, voire de certitude grâce à la RT-PCR. Cependant, il ne faut pas occulter le risque de négliger des pathologies infectieuses qui pourraient être dues à d’autres agents infectieux. Le traitement pourrait être par excès orienté vers une prise en charge du SARS COV 2, voire une absence de prise en charge, soit par saturation des structures de soins par les cas de Covid-19, ou encore liée aux carences des systèmes sanitaires nationaux, y compris dans les pays développés.
Mots clés : SARS COV 2, Covid-19, TDM, RT-PCR.
Abstract: The current Covid-19 pandemic has undergone since its emergence a very rapid diffusion for several months. All countries are affected, with a number of cases which to date exceeds 4,000,000, 282,000 deaths and 1.4 million healings. In Algeria, the cases confirmed today (May 10, 2020) are close to 5,723 cases, including 502 deaths and 2,678 cures. The kinetics of the epidemic appears to be slowing, thanks in particular to barrier and containment measures. A cautious optimism is looming, always with the fear of a second epidemic wave. COVID-cases are diagnosed and managed according to probability or even certainty criteria using RT-PCR. However, the risk of neglecting infectious pathologies which could be due to other infectious agents should not be overlooked. The treatment could be, by excess, oriented towards taking charge of SARS COV 2, or even a lack of care, either by saturation of care structures with Covid-19 cases or linked to the deficiency of national health systems, including those in developed countries.
Keys words: SARS COV 2, Covid-19, TDM. RT-PCR.
La pandémie provoquée par la diffusion du coronavirus Covid-19 pose actuellement un problème majeur de santé publique mondial avec une incidence des infections et des décès qui augmente de façon alarmante dans beaucoup de pays. A l’instar des autres pays, l’Algérie est confrontée à ce fléau mais avec des chiffres de contaminations et de décès moins conséquents, qui demeurent néanmoins élevés. La maitrise de cette pandémie repose actuellement sur une réduction du risque de contamination, basée sur des mesures d’information, d’isolement (pouvant aller au confinement de masse), de strict respect des mesures barrières, du dépistage et de la prise en charge des cas suspects [réf : notes ministérielles N° 4, 5, 20 du 20, 27/02 et 05/05/2020, relatives à la gestion de cas suspects et/ou confirmés de Covid-19] ; en attendant la mise au point de vaccins efficaces. Ces derniers, suivent une procédure accélérée de tests et de validation dans de nombreux pays (plus d’une centaine).
En Algérie cette crise sanitaire du SARS COV 2 se démarque par un profil épidémiologique d’ampleur à un degré moindre, d’aspect lent avec tendance timide à la stabilité, voire la régression de cas. Ceci est secondaire à la réactivité précoce des autorités dès la confirmation du premier cas d’importation (le 25 février, un italien d’une base de vie du sud confirmé Covid-19 positif) ; et du premier cluster de 16 personnes de Blida (ayant organisé un mariage avec présence d’un algérien résidant en France confirmé positif dès son retour chez lui). Dû à un virus émergeant qui fait couler depuis décembre 2019 beaucoup d’encre (des milliers publications), le Covid-19 se démarque par sa haute virulence, avec une rapidité de réplication (5 à 10 fois), une production de nombreux agents pathogènes pour une réponse immunitaire et inflammatoire moindre.
Mais étonnamment, ce Covid-19 peut provoquer chez certains sujets infectés, une symptomatologie des plus variées, avec une myriade de signes cliniques, principalement respiratoires, digestifs, cutanés et neurologiques (plus fréquemment des AVC mais parfois d’authentiques atteintes du système nerveux), générant une variété de tableaux cliniques parfois atypiques, lesquels sont considérés dans le contexte épidémiologique actuel comme liés au Covid-19, au risque de mésestimer une autre pathologie infectieuse.
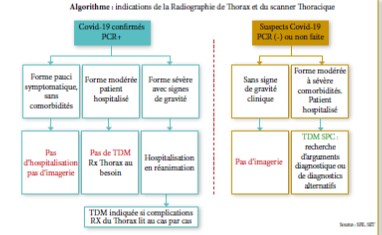
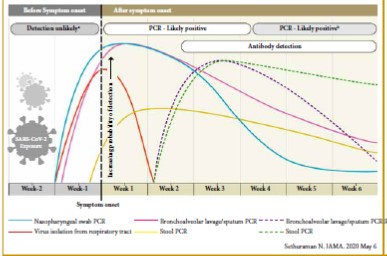
Des éléments paracliniques, biologiques et radiologiques confortent le diagnostic de présomption, seule la RT-PCR, gold standard diagnostique permet de confirmer l’infection au Covid-19 (Spécificité : proche de 100% ; sensibilité globale moins bonne : 64% [1] ; Sensibilité : première semaine >83,3% et deuxième semaine >90% [2].
Par ailleurs, si des patients présentent un tableau clinique et des images tomodensitométriques (TDM) typiques, d’autres peuvent être pauci ou asymptomatiques, tout en présentant des images radiologiques évocatrices.
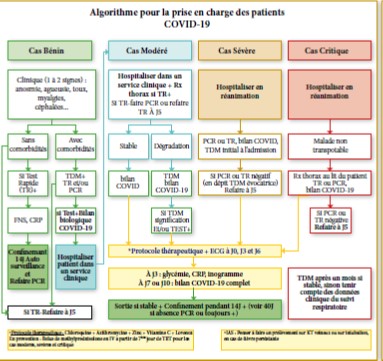
Au sein de l’hôpital spécialisé en maladies infectieuses d’El Kettar, ces patients qu’ils soient suspects ou confirmés, sont pris en charge de manière bien codifiée par un personnel de santé dédié (médical, techniciens, personnel paramédical), dans un circuit d’acheminement et des locaux séparés de consultation et d’hospitalisation. Le traitement est aussi codifié selon la gravité de l’atteinte et des contre-indications, selon les circulaires et notes ministérielles [3] en complément de [4]. En cas de nécessité, les patients sont transférés vers les services de réanimation des hôpitaux. La surveillance tant des sujets-contacts que des patients confirmés et de l’évolution de ces derniers vers la guérison est basée sur les analyses virologiques répétées de manière spécifique [5].
Il existe cependant, dans ce contexte particulier, un risque de négliger d’autres pathologies, potentiellement graves qui s’expriment aussi par des atteintes de l’appareil respiratoire en particulier. Nous nous proposons d’exposer deux cas cliniques édifiants. Si l’un était lié au Covid-19, l’autre était dû à une authentique infection respiratoire, non liée au même virus.
Cas clinique N°1
Homme de 60 ans originaire d’Alger (Bab el Oued) sans antécédents pathologiques particuliers, père de 2 enfants (fille asthmatique) épouse à comorbidité (diabète et HTA), non vacciné contre la grippe, torréfacteur de profession, pratique de la natation depuis plus de 10 ans, sans notion épidémiologique d’exposition au risque Covid-19 (si ce n’est qu’il rapporte avoir rendu visite à un parent hospitalisé pour une infection communautaire le 1er mars).
Il consulte le 04 avril pour : syndrome pseudo grippal fait de toux, asthénie, céphalées d’installation progressive au cours des dix derniers jours avant son hospitalisation.
A l’admission : état général moyen, température (T°) : 38,5°C, fréquence respiratoire (FR) à 24c/mn, tension artérielle (TA) à 130/82 mmHg, toux grasse, asthénie profonde, céphalées intenses avec de fins râles crépitants au champ pulmonaire gauche et une dyspnée de grade 2 de NYHA avec une saturation en oxygène (SaO2) à 89% à l’air ambiant (AA) ;
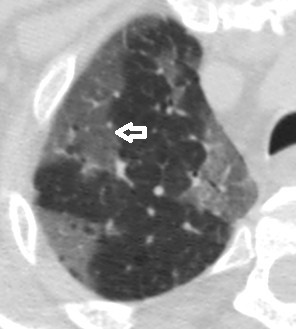
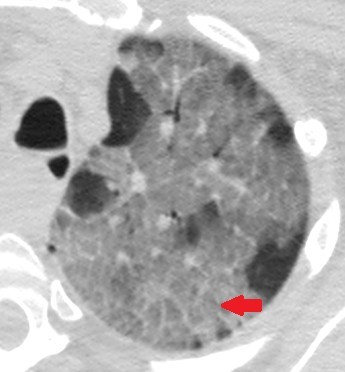
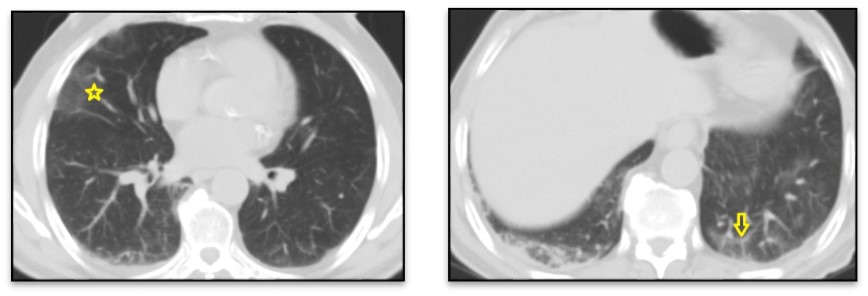
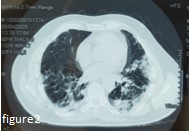
NFS : 5.800 de leucocytes/mm3 sans lymphopénie avec un taux de plaquettes normal. Un téléthorax pratiqué debout de face révèle un syndrome alvéolo-interstitiel bilatéral avec quelques foyers de condensations (fig. 1) ; Complété par une TDM thoracique (fig. 2), objectivant des opacités bilatérales en verre dépoli, de topographie périphérique, sous-pleurale, prédominant sur les lobes supérieurs associées à un épaississement des septa inter et intra-lobulaires réalisant un aspect de crazy paving, ainsi que des condensations en bandes bilatérales de topographe périphérique sous pleurale, plus marquées dans les lobes supérieurs.
La RT- PCR de Covid-19 faite, s’est avérée négative. Un traitement à base de C3G est entamé, le malade est alors transféré vers une autre unité d’hospitalisation. Malgré la mise sous antibiotique, T° à 38,7°C ; la fonction respiratoire du malade se détériore, FR de 24 cycles/mn à 40 cycles/mn), une TA : 135/80 mmHg avec une dyspnée de grade 3 de NYHA et dégradation de sa saturation (passant de 89% à 85% à l’AA, rendant le patient oxygéno-dépendant un score de News2 à 9.
Devant les données para cliniques suivantes : CRP à 146 mg, cytolyse hépatique à 5 fois la normale, les gamma-glutamyl-transférases à 6 fois la normale, les phosphatases alcalines à 2 fois la normale, LDH à une fois et demi la normale, une hyponatrémie à 129 mEq/l et une protéinurie au Labstix® témoignant d’une néphrite d’où redressement du diagnostic évoquant fortement une pneumopathie atypique. Ayant motivé la mise du patient sous quinolone : levofloxacine 500 mg : 2 fois/jour pour une durée de 14 jours et additifs : de la vitamine C en poudre : 4 c.m. 2 fois/jour (2gr/j), de la vitamine D 3.200.000 UI une ampoule de 1 ml, du Zinc : 10 mg/j (1cp/j).
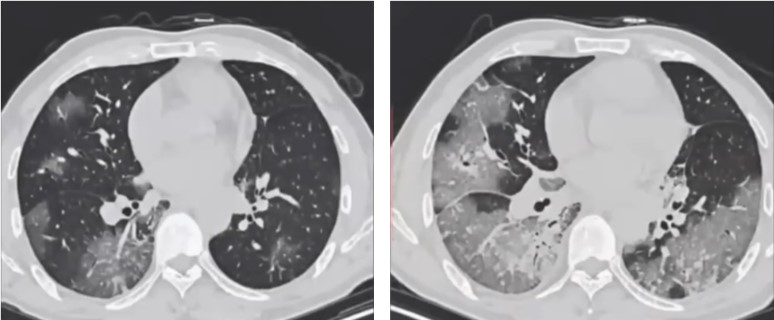
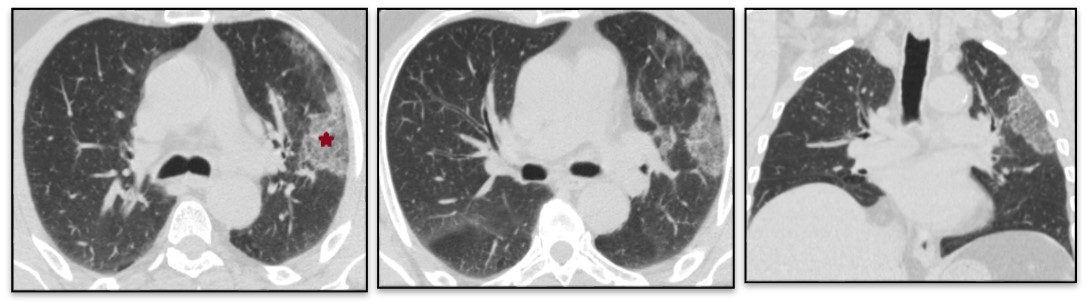
Avec une réalisation d’une deuxième RT-PCR (à 72 heures de la première, également revenue négative). Une excellente évolution est notée dès J2 de traitement avec obtention d’une apyrexie, amélioration sur le plan respiratoire avec réduction de la dyspnée, remontée de la saturation en O2, et normalisation de la fréquence respiratoire. A J3, le patient est presque asymptomatique, en dehors d’une asthénie légère et une discrète toux et à J4, le malade est porté sortant avec un relai par voie orale de la levofloxacine, puis est revu au contrôle à J14 seule plainte notée : discrète asthénie. A J35 une TDM est réalisée objectivant une discrète amélioration avec état général du malade conservé (fig. 3).
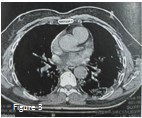
Cas clinique N°2
Homme de 66 ans, marié, originaire d’Alger, médecin, installé à Blida.
Antécédents : vaccin antigrippal reçu, hypertendu sous Atacand® (1cp à 8mg/j de Candésartan cilexetil) depuis 5 ans et ulcère gastrique hémorragique en 2017. On retrouve la notion de contact avec des cas suspects de Covid-19.
Le 19/03/20 : début des symptômes : diarrhée avec T° à 40°C.
Le 22/03/20 : RT-PCR faite à Blida sur prélèvement naso-pharyngé, négative pour le SARS COV2.
Le 30/03/20 : le patient est hospitalisé à l’EHS El Hadi Flici devant l’aggravation de la symptomatologie avec l’apparition d’asthénie, d’une toux sèche, d’une dyspnée et de douleurs abdominales diffuses. L’examen clinique révèle un état général moyen, une pâleur cutanéo muqueuse, une T à 40° C, une fréquence cardiaque (FC) à 120 batt/mn, FR : 32 cycles/min, TA : 130/70mm Hg et une SaO2 à 89% à l’AA, et à 93% sous 3l d’O2. Score de Glascow : 15/15, score News à 09 : risque élevé.
A l’examen clinique, pas de cyanose, dyspnée au stade 3 de NYHA, tachypnée sans signes de lutte, de fins râles crépitant aux bases pulmonaires. Examens ORL, cutané et cardiaque sans anomalies.
Examens paracliniques : NFS sans anomalies, RT-PCR SARS COV 2 positive (31/03/20).
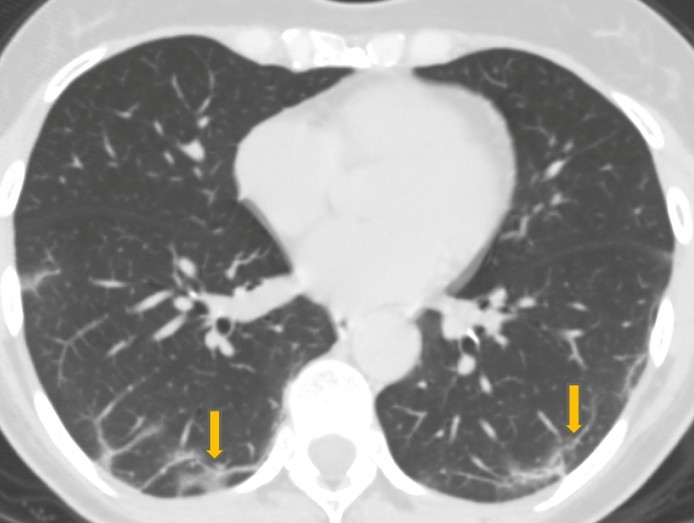
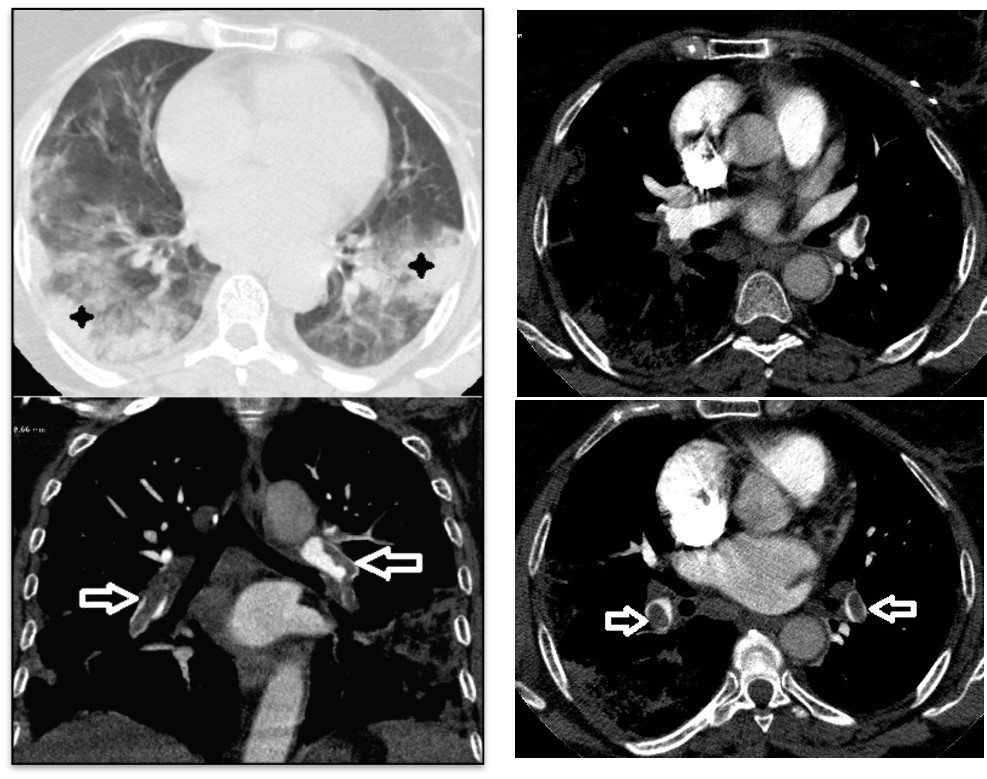
Un bilan pré-thérapeutique est réalisé : glycémie, bilan hépatique, CRP, ionogramme et un ECG pré-thérapeutique avec QTc : 366 ms. Téléthorax : syndrome interstitiel (fig. 4).
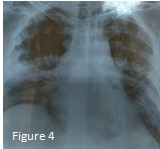
Le patient est mis sous traitement spécifique, se référant au protocole de prise en charge d’un cas de Covid-19 à base d’hydroxychloroquine : 200 mg 3 fois/jour durant 10 jours, associé à de l’azythromycine : 500 mg le premier jour puis 250 mg/jour durant 4 jours.
Des mesures symptomatiques sont assurées : oxygénothérapie, Omeprazole (Mopral®), antipyrétique, anti-diarrhéique et additifs : de la vitamine C en poudre : 4 c.m. 2 fois/jour (2 gr/j), de la vitamine D 3.200.000 UI, du Zinc : 10 mg/j (1 cp/j).
Avec une surveillance clinique biquotidienne, biologique tous les deux jours et un ECG à J3, J6 et J9 du traitement.
Le 05/04/20 : à J18 des symptômes, soit J8 d’hospitalisation et J5 d’hydroxychloroquine et d’azythromycine, plainte du patient asthénie et anxiété avec T° : 36,7°C ; FC : 112 batt/min, FR : 24 c/min, TA : 130/70mm Hg, SaO2 : 83% à AA et 88% sous 5 l d’O2. Un score de News à 9. Un corticoïde (CTC), du Solumedrol® (méthylprednisolone) 40 mg 2 fois/jour est ajouté au traitement pour une durée de 5 jours.
Le 06/04/20 : à J19 des symptômes, J9 d’hospitalisation et J6 d’hydroxychloroquine et J2 de CTC, T° : 37°C, TA : 160/70 mmHg, FR : 28 c/min, SaO2 : 80-81% AA, 85-87% sous 8 l O2. Score News à 9.
Dyspnée grade 3, râles crépitants plus marqués à droite avec une accentuation des images réticulo-nodulaires. CRP : 304 mg/l, cholestase ASAT/ALAT : (36/52), GGT/PAL : (348/261), LDH : 430, Albumine : 28g/l. ECG : QTc : 407 ms.
Maintien des mesures thérapeutiques avec ajout d’albumine injectable : 1 flacon par jour. Antiacide (IPP) en injectable (Mopral® : 40 mg en perfusion).
Le 08/04/20 : J21 de symptômes, à J11 d’hospitalisation, J8 d’hydroxychloroquine et J4 de CTC : le patient est apyrétique, TA : 160/80 mmHg, FC : 112 batt/min, FR : 35c/min, SaO2 : 87% sous 6 l d’O2, score News à 10.
Plaintes : toux intermittente, dyspnée d’effort grade III, épigastralgies. On note un subictère avec présence de râles crépitant aux 2/3 inferieurs de l’hémi-champs pulmonaire droit avec diminution du murmure vésiculaire au niveau de la base droite.
Le 09/04/20 : J22 symptômes, J12 d’hospitalisation, J9 d’hydroxychloroquine et J5 de CTC
État général moyen, apyrexie, TA : 140/70 mmHg, FC : 90 batt/min, FR : 30c/min, SaO2 : 92% sous 6 l O2, dyspnée d’effort stade III, avec score de News à 10.
ECG (fig. 5) : tachy ACFA (142 batt/min) secondaire à l’hydroxychloroquine sans douleurs thoraciques ou de signes d’insuffisance cardiaque.
Dosage Troponine : 0,026 ng/ml, NT pro BNP : 3972 pg/ml (8,8 fois la normale), D-Dimères : 3,18 élevé, fibrinogène : 2,58 g/l. Ionogramme (Na+/K+) : 134/4,4mEq/l.
Arrêt de l’hydroxychloroquine et mise sous un inhibiteur de protéase : Lopinavir/Ritonavir à la dose de 2 cp (200/50) 2 fois jour ; Digoxine : ½ ampoule 2 fois/jour pendant 3 jours ; Bisoprolol ¼ cp (5mg) ; Furosémide injectable ; 20 mg ; Lovenox 0,4 UI/s/c 1 fois/jour. Avec une surveillance quotidienne de l’ECG, troponine et NT Pro BNP 1 jour sur deux.
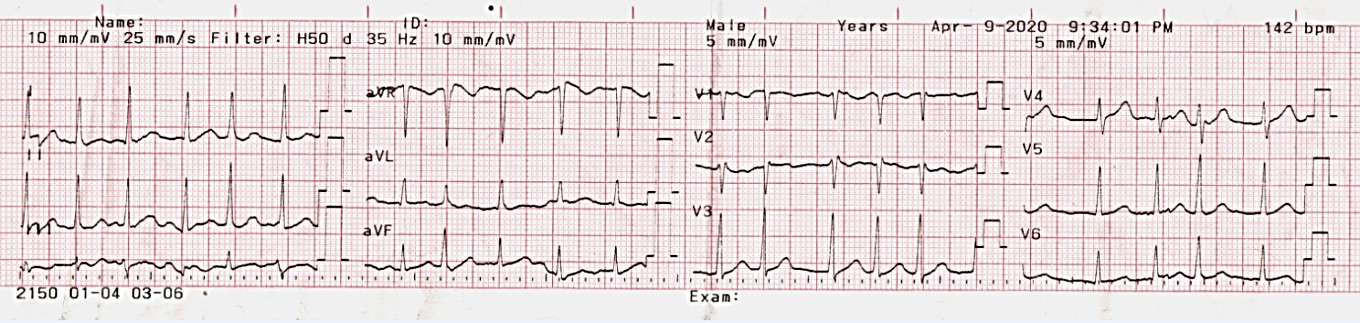
Figure 5 : Image du tracé ECG du 09/04/2020
L’évolution à partir 10/04 est stable sur le plan cardiaque : pas de douleurs thoraciques, ni de palpitations ; FC : 85 à 90 batt/min avec TA à 140/70 mmHg ; troponine 0.019 ; Pro BNP : 4,5 ; normal ; score News 08 ECG : rythme sinusal régulier ; onde P positive ; pas de trouble de la repolarisation ; QT/QTc : 314/390 ms.
Échographie trans-thoracique : VG non dilaté, hypertrophié, de bonne fonction systolique. Bonne cinétique globale et segmentaire ; pas de vice valvulaire significatif, bonne fonction systolique, PAPS (40 mmHg) très élevée, absence d’épanchement péricardique.
Sur le plan respiratoire pas de détresse respiratoire, FR : 30c/min, SaO2 : 86% à AA, et 92% sous 6l d’O2.
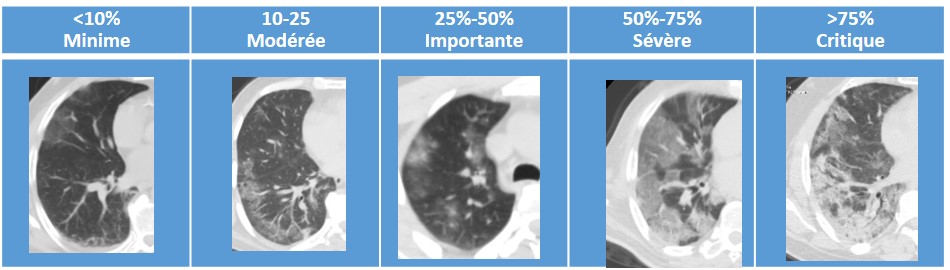
Angio scanner thoracique aspect en faveur d’une atteinte du Covid-19 étendue (25-50%), avec dystrophie emphysémateuse de type lobulaire, bilatérale au niveau des apex et para septale ailleurs.
Sur le plan digestif : le transit s’est normalisé ; l’abdomen est souple, non distendu.
Apparition d’engelures au niveau des orteils du pied gauche sans ischémie.
Bilan : CRP : 21g/l ; LDH : 304 ; GGT : 491, phosphatase alcaline : 202 ; ASAT/ALAT : 29/50, D-Dimères : 3,18 micro gr, Ionogramme Na+/K+ : 130/4.9 mEq/l. Bilan rénal normal.
Le 12/04/20 : J25 symptômes, J15 d’hospitalisation, état général bon, apyrétique, dyspnéique, TA : 120/70 mmHg, FC : 90-100 batt/mn, FR : 27 c/min, SaO2 : 94% sous 5 l d’O2, désaturant à l’effort à 86-87% sous O2 ; Score News : 9.
ECG : tachycardie régulière QTc : 374ms.
CRP 19 mg, glycémie capillaire : 5,70 mg diabète inaugural mis sous insuline avec des bolus. Pro BNP : 171, Troponine : 0,016.
Surveillance de la courbe glycémique, traitement poursuivi avec mise sous insuline pour diabète inaugural.
Évolution favorable. Persistance d’un discret subictère conjonctival, la dyspnée est de moindre intensité, patient moins anxieux, toux discrète sèche intermittente avec persistance de fins râles aux bases.
CRP : 10 mg/l, glycémie à 1,60 g/l, Bilirubine totale : 6,75 mg/l ; bilirubine directe : 3,72 mg/l, albumine : 35g/l ; score de News à 5. Le malade est porté sortant après équilibre de son diabète et convoqué à un contrôle 10 jours après avec consultation en cardiologie et en endocrinologie au CHU de Beni Messous.
Discussion
Le Covid-19 est une maladie infectieuse virale émergente, d’expression majoritairement pulmonaire au premier plan. Infection étonnante à caractère hétérogène dont la forme clinique peut être a/pauci-symptomatique, mais réalisant parfois un SDRA, d’expression systémique variée : cardiaque, vasculaire, cutanée, neurologique et thrombotique pouvant mimer un diagnostic différentiel du Covid-19 .
Les éléments du diagnostic positif, tant de quasi-certitude basée sur la RT-PCR, que de probabilité d’après des critères d’abord épidémiologiques et sur la TDM, sont bien codifiés par les instructions et notes ministérielles [6], basées sur les conclusions du comité scientifique installé à l’occasion de la survenue de l’épidémie, le diagnostic différentiel peut se poser en termes de signes et d’évolution cliniques [7]. Le principal étant la pneumonie bactérienne communautaire, bien que dans ce dernier cas, les images soient systématisées dans un segment, ou un lobe pulmonaire, bien délimitées par les espaces pleuraux.
La TDM pourrait alors monter des images en verre dépoli, des nodules centro lobulaires avec un épaississement pariétal bronchique et des impactions mucoïdes (bouchons). Ces dernières sont absentes dans le covid-19, ainsi que les nodules centro lobulaires, en l’absence de surinfection. D’autres pneumonies comme celles à pneumocystis jiroveci peuvent donner des images TDM voisines en verre dépoli, mais surviennent habituellement chez des patients immunodéprimés. Il est par contre plus difficile de faire la différence avec les autres pneumonies virales bien que les anomalies TDM prédomineraient plus fréquemment en périphérie et moins d’épanchement pleuraux et d’adénopathies [7]. Par ailleurs, à l’inverse de la RT-PCR, les images TDM ont une spécificité élevée mais une sensibilité modérée pour établir aussi un diagnostic différentiel avec les pneumonies virales. Le contexte épidémiologique et les signes cliniques [8], permettent d’orienter le diagnostic avant infirmation ou confirmation sous traitement.
Lorsque la RT-PCR ne peut être réalisée, l’imagerie est d’un apport significatif, surtout dans un contexte épidémiologique et clinique évocateur. (N.B : la radiographie standard est peu spécifique) [17], la TDM est le plus souvent en faveur d’une pneumopathie bilatérale avec des anomalies de distribution en périphérie et sous pleurale, associées à des aspects en verre dépoli, des opacités réticulaires et condensations alvéolaires.
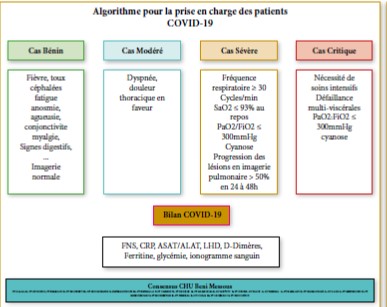
La prise en charge est dépendante des marqueurs cliniques, biologiques, et radiologiques (TDM thoracique) prédictifs du degré de sévérité du tableau clinique.
Une souffrance myocardique est retrouvée chez 10 à 20% des patients, documentée par une élévation de la troponine au-delà du 99ème percentile, des modifications électrocardiographiques et/ou écho cardiographiques. [9].
L’hyperglycémie était retrouvée chez 45% et 52% des patients dans les études de Wu et al. [10] et de Chen et al., respectivement [11]. Elle peut être expliquée par l’hypersécrétion de glucocorticoïdes endogènes, secondaire dans le contexte de stress induit par l’infection, ou par l’utilisation de corticoïdes à visée thérapeutique. Ilias et al ont suggéré que le SARS-CoV-2 pourrait avoir une action directe dans le dérèglement glycémique comme le SARS-CoV-1 ou le Mers-CoV, qui, respectivement, provoquaient une défaillance des îlots de Langerhans et activait la Di Peptidyl Peptidase 4 (DPP4) [12].
Enfin, des lésions cutanées sont évoquées. Peu de publications confirmant leur association au Covid-19. Des lésions maculo-papuleuses érythémateuses touchant exclusivement le visage, et des lésions à types d’engelures, possiblement liées au Covid-19 sont en cours de recueil aux États-Unis, dont le premier cas a été notifié chez un enfant de 13 ans en Italie, dépisté Covid positif. Des réactions urticariennes ont aussi été observées au décours de l’infection, bien qu’elles puissent être aspécifiques [13].
Il est suggéré devant un tableau septique avec dysfonction d’organes, d’utiliser le score de NEWS 2 (score d’alerte précoce à utiliser en complément du jugement clinique, et non pour le remplacer), plus adapté pour une évaluation initiale, une surveillance, et apprécier la gravité [14].
Des études ont noté l’apport significatif d’une anticoagulation préventive par héparine de bas poids moléculaires pour prévenir des accidents thrombotiques, une éventuelle embolie pulmonaire et de réduire le risque de mortalité chez les patients Covid-19 à taux de D-Dimères à 6 fois la normale [15].
À relever la fréquente élévation des polynucléaires neutrophiles et une lymphopénie [10,16].
Une élévation de la CRP (60,7–85,6 %), jusqu’à 150 mg/L, une hypo albuminémie (médianes 32–32,3 g/L), hyperferritinémie [10,17].
Élévation des ALAT/ASAT dans environ 25% des cas (21,7–31%) et hyper-bilirubinémie (5,1–10,5%) [10,18].
Élévation des LDH pour environ 40% des patients (13–98% selon le seuil choisi dans les études) associée à une diminution du TP (jusqu’à 94% des patients) et à une augmentation des D-dimères (23,3–46,4 %), stigmates d’une coagulopathie associés aux formes graves et prédictives de la mortalité [10,17].
Élévation de la troponine chez 17% des patients avec 23% d’insuffisance cardiaque aiguë [17].
On note la rareté de l’anémie, la thrombopénie et de l’insuffisance rénale, cette dernière est plus fréquente en USI chez les patients présentant des complications multiples [10].
Il a été notablement rapporté que la survenue d’un SDRA et de décès étaient liés à l’augmentation des paramètres suivants : D-dimères > 1 micro gr/mL, des polynucléaires neutrophiles, hyper-bilirubinémie totale, élévation LDH et à une baisse du TP, hypoalbuminémie, lymphopénie [10,17]. Une revue des données bibliographiques confirme que l’élévation des ASAT/ALAT, de la créatininémie ou de la troponine étaient prédictifs de mortalité. Si à l’instar de l’élévation des LDH était fortement corrélée à un pronostic négatif (ratio de probabilité R=58 pour LDH >365 U/l), d’autres, comme une élévation de la CRP-hs (haute sensibilité), l’étaient un peu moins (R=17), et encore moins, pour une lymphopénie (R=2,65). Un risque élevé de mortalité était associé par ailleurs à une augmentation de l’aspartate amino-transférase (AST) et l’alanine amino-transférase (ALT), D-Dimères, neutrophiles élevés, procalcitonine, troponine cardiaque normale et hs, ainsi qu’une baisse des monocytes, des plaquettes sanguines et t d’albumine [1].
Les signes vasculaires, dont l’importance est peut-être mésestimée au vu de données d’autopsies [19], pourraient réorienter la caractérisation du Covid-19 vers le “concept d’endothélite vasculaire-Cov-19-induite”. Le virus trouve en effet un accès infectieux dans l’expression du récepteur ACE2, tant dans les pneumocytes 2 que de manière diffuse dans les endothéliums vasculaires avec des atteintes observables au niveau des lits vasculaires de divers organes (d’où les lésions constatées au niveau du cœur, du rein, du foie, du tube digestif). Cette approche de l’infection Covid-19 permettrait autant de requalifier l’infection par ses conséquences systémiques avec des atteintes potentiellement multi-viscérales avec des degrés de gravités variables, accrues par les comorbidités souvent retrouvées, qui concernaient les organes susmentionnés, tout en fournissant un support physiopathologique à des prescriptions thérapeutiques ciblées (anti-inflammatoires anti-cytokines, anti-ACE2, statines … en particuliers pour les patients à risques : âge avancé, sexe masculin, HTA, diabète, néphropathies, pathologies cardiovasculaires).
Conclusion
L’actuelle pandémie de Covid-19 a provoqué une production importante de données cliniques, radiologiques et de laboratoire, aussi bien que de données relatives à des essais cliniques d’anti-infectieux et de vaccins pour faire face à un virus dont les caractéristiques de diffusion mondiale et les effets restent à préciser et expliquer en termes de pathophysiologie. Ses effets sur l’appareil respiratoire demeurent parfois redoutables chez les personnes à risque, mais cela ne saurait occulter, voire de diagnostiquer par excès, d’authentiques infections respiratoires, dues à d’autres agents infectieux, bactériens ou viraux.
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts.
Remerciements : Au Pr Toumi pour sa précieuse contribution dans la rédaction de l’article. Aux virologistes de l’institut Pasteur, Sidi Fredj (Dr Derar, Pr Bouzeroub, Pr Benslimani, Pr Mohamedi). À l’équipe de cardiologie du Pr Chettibi du CHU Issaad Hassani de Beni-Messous pour leur accompagnement dans la prise en charge sur le plan cardiologique des patients Covid-19 de l’EHS El Kettar.
Références
- Siordia Jr J.A. Epidemiology and clinical features of COVID-19: A review of current literature. Journal of Clinical Virology 127 (2020) 104357
- [MSPRH/ DGP : instruction ministérielle N°9/ DGSSRH du 16/04/2020, relative à la démarche diagnostique et thérapeutique du Covid-19]
- [MSPRH/ DGP : instruction ministérielle N°9/ DGSSRH du 16/04/2020, relative à la démarche diagnostique et thérapeutique du Covid-19 ;
- [MSPRH/ DGP : note additive N°06 du 06/04/2020 relative au traitement spécifique des cas de Covid-19)].
- [MSPRH/ DGP : note ministérielle N°07 du 08/03/2020 relative aux critères de guérison d’un cas de Covid- 19 et des sujets contacts infectés].
- [MSPRH/ DGP : note ministérielle N°20 du 05 Mai 2020 relative à l’actualisation de la définition de cas de COVID-19]
- [C. Hani et al. / Diagnostic and Interventional Imaging 101 (2020) 263–268]
- [Bai H.X. et al. Performance of radiologists in differentiating COVID-19 from viral pneumonia on chest CT. Radiology (2020) Mar 10:200823]
- Doyen D, Moceri P, Ducreux D, Dellamonica J. Myocarditis in a patient withCOVID-19: a cause of raised troponin and ECG changes. Lancet 2020.
- Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med 2020:e200994,http://dx.doi.org/10.1001/jamainternmed.2020.0994.
- Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020;395(10223):507–13.].
- Ilias I, Zabuliene L. Hyperglycemia and the novel Covid-19 infection: Possible pathophysiologic mechanisms. Med Hypotheses 2020;139:109699,http:// dx.doi.org/10.1016/j.mehy. 2020. 109699.
- CORONAVIRUS–COVID-19–Événements SFD. https://evenements-sfd.fr/coronavirus-covid-19/. Consulté le 12-avr-2020.] How dermatologists can learn and contribute at the leading edge of the covid-19 global pandemic. Lauren M Madigan and al JAMA Dermatology 30 Avril 2020
- Mellhammar L, Linder A, Tverring J, Christensson B, Boyd JH, Sendi P, et al. NEWS 2 is superior to qSOFA in detecting sepsis with organ dysfunction in the emergency department. J Clin Med 2019;8(8):1128
- Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost 2020:10, http://dx.doi.org/10.1111/jth.14817]
- Tartour E Dysregulation of immune response in patients with covid-19in Wuhan, China. Clin Inf Dis March 12 2010.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020;395(10229):1054–62.
- Guan W, Ni Z, Hu Y, Liang W, Ou C, He J, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med 2020,http://dx.doi.org/10.1056/NEJMoa2002032. NEJMoa2002032.
- Varga Z. et al. Endothelial cell infection and endotheliitis in COVID-19 Lancet (2020) Vol 395 May 2, 2020.
Télécharger le PDF de cet article