Les injections intra-articulaires d’acide hyaluronique dans le traitement de la gonarthrose ont prouvé leur efficacité dans de nombreuses études. La simplicité du geste et l’efficacité du produit ont fait que cette pratique soit largement adoptée par les médecins rhumatologues.
A. Mameche, R. Allat, C. Haouichat, Service de Rhumatologie, CHU Djillali Bounaâma de Douéra, Alger.
Date de soumission : 24 Juin 2020
Résumé : les injections intra-articulaires d’acide hyaluronique dans le traitement de la gonarthrose ont prouvé leur efficacité dans de nombreuses études. La simplicité du geste et l’efficacité du produit ont fait que cette pratique soit largement adoptée par les médecins rhumatologues. La tolérance de la visco-supplémentation est considérée comme satisfaisante comparée à celle des autres thérapeutiques à savoir, les antalgiques, les anti-inflammatoires non stéroïdiens dont on connaît la toxicité cardiovasculaire et digestive, et autres traitements locaux (corticoïdes). En effet les effets indésirables restent mineurs dans la grande majorité des cas, mais cela n’empêche que son utilisation impose des précautions rigoureuses. Ce travail est une revue des effets secondaires observés au cours de l’utilisation de la visco-supplémentation dans le traitement de l’arthrose du genou.
Mots Clés : Gonarthrose, acide hyaluronique, visco-supplémentation, tolérance.
Abstract: The intra-articular injections of hyaluronic acid in the treatment of knee osteoarthritis, have proven their efficacy, this efficacy, in addition to the simplicity of the gesture led the practitioners to integrate it into their daily practice. The tolerance of the visco-supplementation is considered as satisfying compared to that of other therapeutics such as, the analgesics, the non-steroidal anti-inflammatory which cardiovascular and digestive toxicity is well known, in addition to other local treatments (corticoids). In fact, the undesirable effects are minor in the vast majority of cases, but this does not prevent that its use imposes rigorous precautions. This work is a revue of the undesirable effects observed during the use of the visco-supplementation in the treatment of knee arthrosis.
Keywords: Gonarthrosis; hyaluronic acid; visco-supplementation; tolerance
Introduction
L’arthrose est un motif de consultation très fréquent en rhumatologie, c’est une source de handicap fonctionnel important, notamment lorsqu’elle concerne une localisation portante et une grosse articulation comme celle du genou.
Un arsenal thérapeutique pharmacologique et non pharmacologique est mis à la disposition du médecin rhumatologue afin de soulager le patient et d’améliorer sa qualité de vie.
Parmi les moyens pharmacologiques, le traitement à base d’injection ou d’infiltration d’acide hyaluronique offrent une approche thérapeutique visant à obtenir une antalgie de plus longue durée.
L’acide hyaluronique est une protéine de type glycosaminoglycane, composé essentiel du liquide synovial, dont le caractère hydrophile lui confère une viscoélasticité responsable de son pouvoir lubrifiant et de ses propriétés amortissantes.
La visco-supplémentation consiste en l’injection intra-articulaire de l’acide hyaluronique exogène, dans le but de lubrifier l’articulation et de restaurer les propriétés rhéologiques du liquide synovial, produisant ainsi des effets mécaniques, analgésiques, anti-inflammatoires et chondro-protecteurs.
Ces acides hyaluroniques exogènes sont classés selon le poids moléculaire comme :
- Produit de faible poids moléculaire : ………………………………………………………. 0,5 – 1 x 106Da
- Produit de masse moléculaire intermédiaire : ………………………………………….. 1 – 1,8 x 106 Da
- Produit de haut poids moléculaire : ……………………………………………………………… 6 x 106 Da
Des études ont comparé l’efficacité des injections d’acide hyaluronique en se basant sur leurs poids moléculaires, les résultats ont conclu à l’absence de différence d’efficacité, ne permettant pas de faire un choix parmi les dérivés d’acide hyaluronique proposés sur le marché [2-3].
Comme tout traitement, la visco-supplémentation peut être à l’origine d’effets secondaires, certains sont propres au produit, d’autres sont imputables au geste lui-même [2-18].
La tolérance de la visco-supplémentation
La tolérance des injections d’acide hyaluronique est globalement satisfaisante. En effet, une méta-analyse récente de la tolérance de l’ensemble des différents acides hyaluroniques intra-articulaires montre que celle-ci est acceptable avec un taux de 8,5 % d’effets indésirables quasi-exclusivement locaux, post-injection, habituellement mineurs, que l’on peut limiter et éventuellement éviter avec une bonne technique d’injection [2-3].
- Effets systémiques
Contrairement aux effets systémiques que produisent habituellement les autres traitements de l’arthrose du genou, notamment les infiltrations cortisoniques, la visco-supplémentation est relativement plus sure, les effets systémiques sont exceptionnels voire inexistants [1], à l’exception de quelques rares cas d’allergie et d’asthénie passagère qui ont été rapportés [2].
- Effets locaux
- Inflammation locale
Réaction précoce, apparaissant de quelques heures à 2 jours après l’injection, modérée, faite de douleurs, rougeur, parfois un épanchement avec compte cellulaire inflammatoire. C’est une inflammation transitoire qui disparait rapidement parfois sous antalgiques et anti-inflammatoires non stéroïdiens. Ce sont des réactions dont la fréquence est faible, ne concernant que 2 à 7% des infiltrations au genou [1-3].
L’origine de ces accès aigus n’est pas claire, certains ont avancé l’hypothèse d’une dépolymérisation de l’acide hyaluronique, en partie sous l’effet du monoxyde d’azote produit dans l’articulation arthrosique. D’autres auteurs ont pu mettre en évidence une activation de la voie du complément [1-4]. Les acides hyaluroniques de haut poids moléculaires semblent être les plus associés à ces réactions [1].
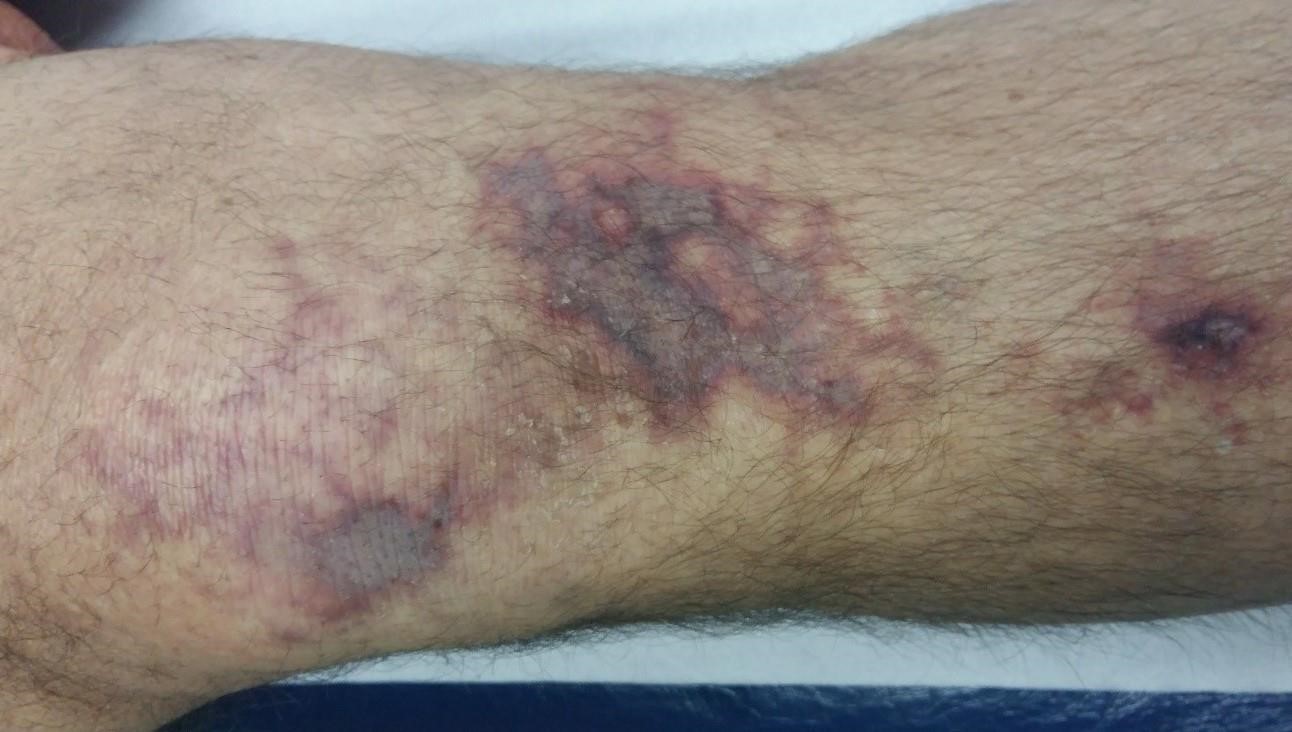
- Nécrose cutanée (fig. 1 & 2)
Dans le cadre de l’utilisation de l’acide hyaluronique en rhumatologie, la littérature rapporte 03 cas de nécrose cutanée suite à une injection intra-articulaire [5].
Le mécanisme pathogénique conduisant à ces nécroses n’est pas clair. Des hypothèses ont été avancées, à savoir la compression vasculaire extrinsèque due à l’injection d’un volume trop important d’acide hyaluronique dans une zone de tension, diminuant la perfusion cutanée ; ou de cause intravasculaire par obstruction intra-artérielle directe (injection de l’acide hyaluronique directement dans une artère). D’autres auteurs mettent en cause l’œdème et l’inflammation réactionnels [5-7].
L’évolution est généralement favorable avec l’application de corps gras et un traitement antiagrégant plaquettaire. La cicatrisation est longue (parfois plus de 6 mois), correspondant au temps nécessaire à la destruction de l’acide hyaluronique [5].
- Arthrite septique
Les infections ostéoarticulaires post-injection restent rares. Quelques cas d’arthrites septiques ont été rapportés avec un traitement par l’acide hyaluronique.
Trois (03) cas à Neisseria mucosa ont été publiés [8-10], le vecteur de contamination a probablement été des gouttelettes de salive, vu que le germe incriminé est un saprophyte de la sphère ORL et du tractus respiratoire [8].
Un (01) cas d’arthrite septique à Staphylocoque aureus dont le mécanisme de contamination articulaire est probablement secondaire à une inoculation directe de la flore cutanée du patient ou de l’opérateur lors de l’injection [8].
L’utilisation de la visco-supplémentation d’une manière répétée et rapprochée, les injections intra-articulaires antérieures ou associées de dérivés cortisoniques, constituent des facteurs de risque d’apparition d’arthrite septique par augmentation du risque d’inoculation de germes [8].
Devant une arthrite après visco-supplémentation, on doit toujours éliminer en priorité une complication infectieuse par la réalisation systématique d’une ponction articulaire avec analyse bactériologique du liquide synovial. Ces arthrites infectieuses peuvent être évitées en imposant des précautions d’asepsie rigoureuses [8].
- Arthrites réactionnelles
Des cas de synovites granulomateuses ont été diagnostiqués et rapportés, suite à l’apparition d’arthrite du genou quelques heures après une injection d’acide hyaluronique. Ces arthrites étaient caractérisées par la présence de liquide inflammatoire stérile et sans microcristaux.
L’hypothèse d’une injection non strictement intra-articulaire pourrait expliquer ces arthrites réactionnelles non infectieuses et non microcristallines par gonflement du tissu graisseux péri-synovial. L’évolution clinique est souvent spontanément favorable en quelques jours [11-13,17].
Des cas de poussées d’arthrite à microcristaux de phosphate de calcium et d’urates de sodium ont été décrits. Ces arthrites sont induites par l’injection d’acide hyaluronique chez des patients qui n’ont parfois aucun antécédent personnel d’arthrite à microcristaux et de chondrocalcinose radiologique.
Des observations suggèrent que les épanchements réactionnels à une injection d’acide hyaluronique seraient plus souvent en rapport avec une synovite macrophagique granulomateuse secondaire à une sécrétion de cytokines pro-inflammatoires, dont la formation est stimulée par les produits de dégradation de l’acide hyaluronique qu’à la présence de microcristaux [11,14-16].
Conclusion
Compte tenu de tout ce qui a été rapporté, la visco-supplémentation généralement proposée en cas d’échec ou d’intolérance des autres thérapeutiques, est globalement bien tolérée (balance bénéfique/risque favorable), sous réserve d’une bonne technique d’injection.
Son efficacité permet une épargne en antalgiques opiacés et en anti-inflammatoires (AINS), et pourrait retarder le recours au remplacement prothétique du genou. Ainsi, le service médical rendu par les injections d’acide hyaluronique dans le cadre du traitement de la gonarthrose reste satisfaisant.
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts en rapport avec cet article.
Références
- Richette P. Visco-supplémentation au genou. Revue du rhumatisme monographies (2016)
- Legré-Boyer. Visco-supplémentation : techniques, indications, résultats. Conférences d’enseignement (2014)
- Emmanuel Maheu. Acides Hyaluroniques dans la gonarthrose, les autres localisations arthrosiques et en extra-articulaire. Revue du Rhumatisme monographies (2020)
- Dragomir CL, Scott JL, Perino G, et al. Acute inflammation with induction of anaphylatoxin C5a and terminal complement complex C5b-9 associated with multiple intra-articular injections of hylan G-F 20: a case report. Osteoarthritis Cartilage 2012; 20:791–5.
- Desmottes M-Charlotte, Delorme L, Clay M, Troussier B, Leccia M-Thérèse, Nécrose cutanée suite à une visco-supplémentation d’acide hyaluronique par injection intra-articulaire du genou chez un patient âgé de 63 ans, Revue du rhumatisme (2020), doi: undefined
- Borregón-Nofuentes P, Avilés-Izquierdo JA, Martínez-Izquierdo MÁ, et al. Livedo reticularis and skin necrosis due to hyaluronic acid embolism. JAMA Dermatol. 2013 Mar;149(3):373-5
- Kim WB, Alhusayen RO. Skin Necrosis from Intra-articular Hyaluronic Acid Injection. J Cutan Med Surg. 2015 Mar-Apr;19(2):182-4.
- Albert et al. Arthrite septique du genou après injection intra-articulaire d’acide hyaluronique : à propos de deux cas/ Revue du Rhumatisme 73 (2006) 294–296
- Abiteboul M, Mazières B, Causse B, Moatti N, Arlet J. Septic arthritis of the knee due to Neisseria mucosa. Clin Rheumatol 1985; 4:83–5.
- Van Linthoudt D, Modde H, Ott H. Neisseria mucosa septic arthritis. Br J Rheumatol 1987 ; 26 :314.
- Laëtitia Michou, Chantal Job-Deslandre, Gonzague de Pinieux, André Kahan. Synovite granulomateuse après injection de hylane GF-20. À propos de deux cas. Revue du Rhumatisme 71 (2004) 821–823
- Jones A, Regan M, Ledingham J, Pattrick M, Manhire A, Doherty M. Importance of placement of intraarticular steroid injections. BMJ 1993;307:1329–30.
- Haslock I, MacFarlane D, Speed C. Intraarticular and soft tissue injections: a survey of current practice. Br J Rheumatol 1995;34:449– 52
- Pullman-Mooar S, Mooar P, Sieck M, Clayburne G, Schumacher R. Are there distinctive inflammatory flares after Hylan G-F 20 intraarticular injections? J Rheumatol 2002;29:2611–4.
- Martens PB. Bilateral symetrical inflammatory reaction to hylan G-F20 injection. Arthritis Rheum 2001;44:978–83
- Bernardeau C, Bucki C, Lioté F. Acute arthritis after intra-articular hyaluronate injection: onset of effusions without crystal. Ann Rheum Dis 2001;60:518–20.
- Chen AL, Desai P, Adler EM, Cesare PE. Granulomatous inflammation after Hylan G-F 20 visco-supplementation of the knee. A report of six cases. J Bone Joint Surg 2002 ; 84-A:1142–7.
- Márcia Uchôa de Rezende1, Gustavo Constantino de Campos. Visco-supplementation. Rev Bras Orthop. 2012;47(2):160-4
Figure 1 : Nécrose cutanée du genou 5 jours après une visco-supplémentation [5]
Figure 2 : La même lésion à un mois d’évolution. [5]