Z. Benabdelkader, Y. Dellaoui, Département de pharmacie, Université Ahmed Ben Bella d’Oran, Algérie.
Résumé : L’augmentation de l’incidence des infections fongiques, notamment chez les sujets immunodéprimés avec ses conséquences redoutables, ainsi que l’émergence de nombreux germes résistants aux traitements actuels suscitent les recherches à développer de nouveaux agents antifongiques. Notre étude a porté sur les propriétés antifongiques des quinoléines; des dérivés 5-phényldiazényl quinoléin-8-ol et la 5,7-dinitro quinoléin-8-ol ont été synthétisés puis identifiés par spectroscopie IR etRMN. L’activité antifongique de ces dérivés a été testée vis–a-vis de C. albicans, A. niger et Trichosporon par la méthode de diffusion sur gélose. Le dérivé 5,7-dinitroquinoléine-8-ol révèle l’activité antifongique la plus puissante notamment vis-à-vis de C. albicans. Les dérivés de la 8-hydroxyquinoléineconstituent une source prometteuse pour la conception de nouveaux agents antifongiques en raison de leur forte activité biologique.
Mots-clés : Antifongiques, 8-hydroxyquinoléine, C. albicans, A. niger, 5,7-dinitroquinoléin-8-ol, 5-phényldiazénylquinoléin-8-ol.
Abstract: The increase in the incidence of fungal infections, especially in immunocompromised subjects with its formidable consequences, as well as the emergence of many germs resistant to current treatments are prompting research to develop new antifungal agents. Our study focused on the antifungal properties of quinolines, derivatives 5-phenyldiazenyl quinolin-8-ol, and 5,7-dinitro quinolin-8-ol were synthesized and then identified by IR and NMR spectroscopy. The antifungal activity of these derivatives was tested against C. albicans, A. niger and Trichosporon by the agar diffusion method. The 5,7-dinitroquinoline-8-ol derivative reveals the most powerful antifungal activity, especially against C. albicans. 8-Hydroxyquinoline derivatives are a promising source for the design of new antifungal agents due to their strong biological activity.
Key-words: Antifungals, 8-hydroxyquinoline, C. albicans, A. niger, 5,7-dinitroquinolin-8-ol, 5-phenyldiazenylquinolin-8-ol.
1. Introduction
Selon les estimations de l’OMS, les maladies fongiques comptent parmi les problèmes sanitaires mondiaux, elles entraînent des taux de morbidité annuelle similaires à ceux provoqués par la malaria et la tuberculose. En plus des décès, ces maladies fongiques conduisent souvent à une mauvaise santé chronique dont la cécité, la détresse respiratoire, la perte de poids etc.
D’autre part, l’émergence de nombreux germes résistants aux traitements disponibles suscitent les recherches actuelles à développer de nouveaux agents antifongiques.
Le noyau quinoléine se trouve dans divers produits naturels, en particulier dans les alcaloïdes, il constitue un précurseur pour la synthèse de nombreux composés aux propriétés pharmacologiques variées.
Les dérivés quinoléiques en particulier la 8-hydroxyquinoléine et ses dérivés font l’objet de nombreuses investigations pour leur activité antifongique.
Notre étude a porté sur l’activité antifongique de la 5,7-dinitroquinoléin-8-ol, de même que certains dérivés 5-[(phényl)diazényl] quinoléin-8-ol.
2. Résultats et discussion
a. Chimie
A partir de la 8-hydroxyquinoléine, 4 dérivés ont été synthétisés: trois composés (1-3) ayant la structure 5-(phényldiazényl) quinoléin-8-ol, et un dérivé nitré (4) (schéma1).
Une réaction de diazo-copulation de la 8-hydroxyquinoléine avec un composé diazoïque dérivé de l’aniline, a permis l’accès aux composés 1, 2, et 3. La nitration de la 8-hydroxyquinoléine par une mixture d’acide nitrique et d’acide sulfurique, a conduit au composé 4.
Schéma 1 : Synthèse des dérivés de la 8-hydroxyquinoléine. (a) dérivé d’aniline, NaNO2, HCl. (b)HNO3, H2SO4.

b. Activité antifongique in vitro
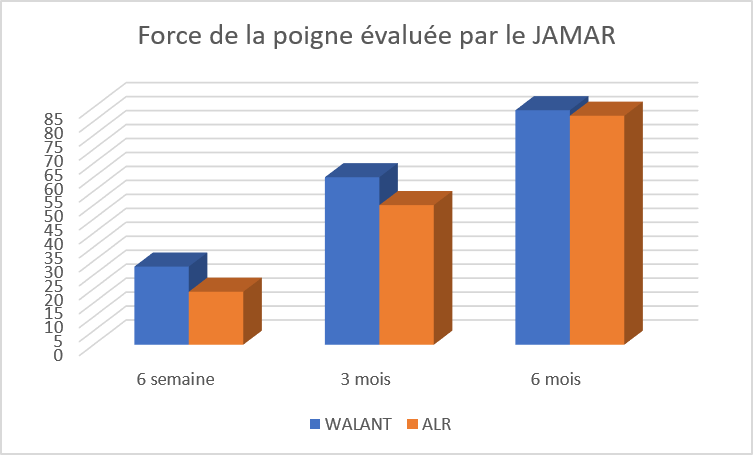
L’activité antifongique des composés 1 à 4 a été évaluée en deux temps, d’abord les composés ont été testés vis-à-vis de deux souches pathogènes de Candida albicans et d’Aspergillus niger par la technique de diffusion sur gélose, méthode des disques en utilisant deux solvants l’acétone et l’eau physiologique stérile.
Les composés 1 à 3 dans l’acétone étaient inactifs vis-à-vis des souches étudiées de Candida albicans et d’Aspergillus niger. Le composé 4 était actif uniquement sur la souche d’Aspergillus niger, le diamètre d’inhibition est de 32mm. Le disque témoin d’acétone a montré que l’acétone ne possède pas d’activité antifongique vis-à-vis des souches testées (figure 1).
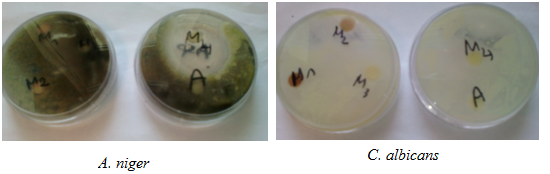
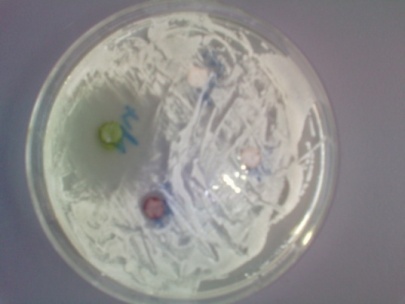
En utilisant l’eau physiologique stérile, seul le composé 4 a révélé une activité inhibitrice sur Candida albicans uniquement, avec un diamètre d’inhibition de 30mm (figure 2). Les composés 1-3 étaient inactifs.
Pour la 5,7-dinitroquinoléin-8-ol une série de dilution de la concentration initiale (10mg/ml) a été faite dans l’eau physiologique stérile (1/10, 1/50, 1/100, 1/200, 1/300, 1/500, 1/1000); puis un test antifongique vis-à-vis de C. albicans a révélé la dernière dilution donnant une activité inhibitrice.
Les résultats obtenus sont résumés dans le tableau 1. Une concentration de 0.1mg/ml est la plus faible concentration active sur Candida albicans. Le diamètre d’inhibition avec la Fluconazole était de 35mm.
|
|
Diamètres d’inhibition en mm |
|
|
Dilution |
1er test |
2e test |
|
1/10 |
32 |
31 |
|
1/50 |
21 |
22 |
|
1/100 |
15 |
17 |
|
1/200 |
6 |
6 |
|
1/300 |
6 |
6 |
|
1/500 |
6 |
6 |
|
1/1000 |
6 |
6 |
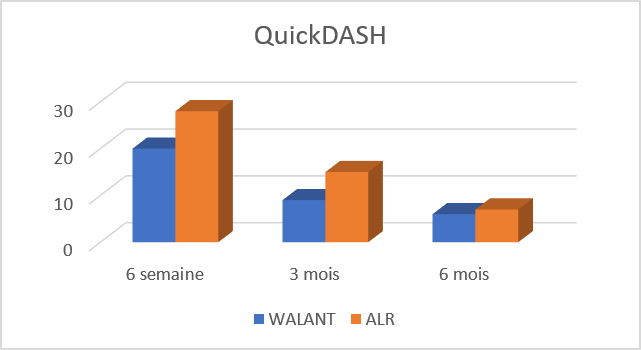
Un deuxième test a été effectué vis-à-vis d’une autre souche pathogène de Candida albicans et d’une souche de Trichosporon, selon la technique de diffusion sur gélose, méthode des puits, en utilisant les deux solvants diméthylsulfoxyde (DMSO) et l’eau physiologique stérile.
Les composés 1, 2, 3 et 5 étaient inactifs vis-à-vis des deux souches de Candida albicans et de Trichosporon, et ceci en utilisant les deux solvants.
Tableau 2 : Diamètres d’inhibition du composé 4 dans le DMSO et l’eau vis-à-vis de C. albicans et Trichosporon.
| Diamètres d’inhibition (mm) de la 5,7-dinitroquinoléin-8-ol | ||
| Solvant | Candida albicans | Trichosporon |
| Diméthylsulfoxyde | 40 | 50 |
| Eau physiologique stérile | 30 | 35 |
Seul le composé 4 a montré une forte activité antifongique vis-à-vis des deux souches (Tableau 2), le diméthylsulfoxyde s’est révélé dépourvu d’activité antifongique.
La 5,7-dinitroquinoléin-8-ol (composé 4) a montré une forte activité antifongique in vitro sur Candida albicans, Aspergillus niger et Trichosporon.
Cependant, l’activité antifongique a été influencée par le type de solvant. Ainsi, l’acétone la 5,7-dinitroquinoléin-8-ol a manifesté une activité antifongique uniquement sur A niger, tandis que dissoute dans l’eau physiologique stérile, l’activité antifongique s’est manifestée uniquement sur C. albicans dans la première étude.
La deuxième étude a montré une forte activité fongique du composé 4 vis-à-vis de C albicans et de Trichosporon lorsque l’eau physiologique stérile et le diméthylsulfoxyde ont été utilisés. Cela indique qu’il est nécessaire de rechercher le solvant permettant d’avoir une activité antifongique maximale.
Les dérivés 5-(phényldiazényl) quinoléin-8-ol, 5-(4-nitrophényldiazényl) quinoléin-8-ol et 5-(4-hydroxyphényldiazényl) quinoléin-8-ol étaient inactifs vis-à-vis des souches de C albicans, d’A niger et de Trichosporon. Ce résultat peut être dû au degré de sensibilité des souches utilisées dans les deux études, les souches pathogènes isolées chez des patients peuvent être plus résistantes que les souches ATCC. D’autre part, la technique d’évaluation de l’activité antifongique in vitro est un facteur déterminant, la méthode de diffusion en milieu gélosé est une technique d’évaluation grossière qui nécessite d’être complétée par d’autres méthodes, telle que la technique du milieu empoisonné (en Anglais Poisoned food technique).
3. Conclusion
Les dérivés de la quinoléine constituent une source prometteuse pour la conception de nouveaux agents antifongiques, en particulier les dérivés de la 8-hydroxyquinoléine qui comporte plusieurs sites réactifs permettant l’accès à des dérivés de structures variées et à forte activité biologique.
Dans cette étude, trois dérivés phényldiazénylquinoléin-8-ol et un dérivé nitré de la quinoléine ont été synthétisés. Leurs structures chimiques ont été confirmées par spectroscopie RMN et IR. L’activité antifongique in vitro de ces dérivés sur des souches pathogènes de Candida albicans, d’Aspergillus niger et Trichosporon a révélé une activité antifongique intéressante du dérivé 5,7-dinitroquinoléi-8-ol.
4. Expérimental
a. Synthèses chimiques
· Composé 1-3
Le dérivé d’aniline (1,3 g d’aniline liquide, 1,5g de 4-nitroaniline solide, 1,5g de 4-aminophénol solide), est dissout dans 1,5 g d’HCl à 5%, cette solution est refroidie dans un bain de glace à 5°C.
10 ml de solution de nitrite de sodium (NaNO2)à 10% sont ajoutés goutte à goutte au mélange dérivé d’aniline/acide chlorhydrique.
1,6 g de 8-hydroxyquinoléine est dissout dans un solvant constitué de 40 ml de NaOH à 5% et 10 ml d’éthanol. La solution obtenue est refroidie dans un bain de glace, puis ajoutée sous agitation sur la solution du composé diazoïque.
L’agitation est maintenue pendant 15 minutes, puis la solution est laissée reposer pendant 10 minutes.
o Séparation des composés
§ Composé 1-2
25 ml de solution d’hydroxyde de sodium à 10% sont ensuite ajoutés, il se forme un précipité très fin.
Le milieu réactionnel est chauffé jusqu’à 50-55°C au bain-marie pour accélérer la précipitation et 5 g de chlorure de sodium sont ajoutés, le chauffage se poursuit jusqu’à ce que le chlorure se dissolve. La solution est refroidie 10-15 minutes à température ambiante puis dans un bain de glace pendant 30 minutes. Une filtration sous vide est enfin effectuée pour bien essorer le précipité. Le composé est recristallisé dans l’eau, puis laissé refroidir. Une filtration sous vide est effectuée. Le solide est séché à 50°C dans l’étuve.
5-(phényldiazényl) quinoléin-8-ol : solide rouge bordeaux. Rendement : 83,71 %. RMN H1 : 9,18-9,80 (d, 1H), 8,68(d, 1H), 7,37-7,39 (dd, 1H), 7,52-7,54 (d, 1H), 6,63-6,66, 7,81-7,87 (m, 1H), 7,60-7,64 (dd, 2H), 7,48-7,54 (m, 2H), 3,37(s, 1H).
5-[(4-nitrophényl) diazényl] quinoléin-8-ol : Solide noir. Rendement : 17,87%. RMN H1 : 8,59-8,60 (t, 1H), 7,93-7,95 (dd, 1H), 7,53-7,56 (dd, 1H), 7,74-7,76 (d, 1H), 6,48-6,50 (d, 1H), 8,19-8,21 (dd, 1H), 8,33, 6,60-6,62 (dd, 1H), 6,75 (m, 1H), 3,37 (s, 1H).
§ Composé 3
Afin de procéder à une séparation du composé 3, une évaporation sous pression a été effectuée 5-[-(4-hdroxyphényl)diazényl]quinoléin-8-ol : Solide noir. Rendement : 68,30%.
· Composé 4 : 5,7-dinitroquinoléin-8-ol
Une solution de 20 ml d’une mixture d’acide nitrique et d’acide sulfurique (7/3) est préparée et refroidie dans un bain de glace. 2g de 8-hydroxyquinoléine sont additionnés par petites proportions sur cette mixture.
2 heures après , le mélange est versé sur 50g de glace. Une filtration sous vide est effectuée. Le solide est lavé avec de l’éthanol, puis recristallisé dans le nitrobenzène.
Le composé est laissé sécher à l’air libre puis dans l’étuve à 50°C.
Solide jaune. Rendement : 66,05%. RMN H1 : 9,80-9,83(dd, 1H), 8,26-8,29 (d, 1H), 8,94-8,95 (dd, 1H), 9,25 (s, 1H), 4,72 (s,1H).
b. Évaluation de l’activité antifongique
· Première étude
o Préparation des solutions à tester
Deux solvants ont été utilisés : l’acétone et l’eau physiologique stérile. 1mg de chaque composé (1,2 et 4) est dissout dans 1ml d’acétone. 10mg de chaque composé sont dissous dans 1ml d’eau physiologique stérile.
Technique de diffusion en milieu gélosé (méthode des disques) : Des disques de 6mm de diamètre ont été confectionnés avec du papier Wattman. Des boites de Pétri contenant la gélose Sabouraud actidione ont été ensemencées avec une suspension à 0.5 Mc Farland de l’espèce étudiée dans l’eau physiologique stérile. L’ensemencement a été fait par écouvillonnage. Les disques imprégnés avec les différentes solutions des composés 1-4 ont été placés au niveau des boites de Pétri. Un disque imprégné d’acétone seule a été utilisé pour évaluer l’activité antifongique de l’acétone vis-à-vis des souches testées, ainsi qu’un disque d’antifongique de référence du commerce.
Après incubation à 28°C pendant 48h pour Candida albicans et 72h pour Aspergillus niger, le pouvoir antifongique du composé est déterminé par la mesure du diamètre d’inhibition. Tous les tests ont été répétés trois fois.
· Deuxième étude
o Préparation des solutions à tester
Deux solvants ont été utilisés : l’eau physiologique stérile et le diméthylsulfoxyde. 10mg de chaque composé ont été dissous dans 1ml de solvant.
Technique de diffusion en milieu gélosé (méthode des puits) : L’évaluation de l’activité antifongique a été effectuée selon la même technique de diffusion en milieu gélosé mais en utilisant cette fois-ci la méthode des puits à la place des disques.
Des boites de pétri contenant le milieu Sabouraud actidione ont été ensemencées par une suspension de l’espèce étudiée dans l’eau physiologique stérile. L’ensemencement se fait par écouvillonnage. Des puits ont été confectionnés dans les boites de Pétri à l’aide d’une pipette Pasteur, chaque puit est rempli avec 10μl de la solution à tester. Deux puits ont été remplis de 10 μl de diméthylsulfoxyde. Les boites de Pétri sont ensuite incubées à 48°C pendant 48 heures. Le pouvoir antifongique des composés est déterminé par la mesure du diamètre d’inhibition.
Références
- Joshi, Shrinivas D. Quinoline: a promising and versatile scaffold for future. 2016, Indo American Journal of Pharmaceutical Research, pp. 5033-5044.
- Baba, Yassir Filali. Synthèse réactivité et propriétés biologiques des dérivés de la quinoléine. 1, 2018, Vol. 17.
- Saleh N Al-Busafi, Fakhr Eldin O Suliman, Zaid R Al-Alawi. 8-Hydroxyquinoline and its Derivatives: Synthesis and Applications. 1, Oman: ISSN, 2014, Vol. 3.
- Vidal 2018.
- Robert Musiol, Josef Jampilek, Vladimir Buchta, Luis Silva, Halina Niedbala. s.l. Antifungal properties of new series of quinoline derivatives.: Elsevier, 2006.
- Azo Dyes. C.T. Keerthi Kumar, J. Keshavayya and Rajesh. s.l. Synthesis, Spectral Characterization and Biological Study of Heterocyclic: IJETSR, 2017, Vol. 4. ISSN 2394 – 3386.
- Vinesh Kumar, Devendra Tyagi. Antifungal activity evaluation of different extracts of Bergenia stracheyi.7, Uttarakhand:s.n., 2013, Vol. 2. ISSN: 2319-7706.
- Zohra, Mohammedi. Étude Phytochimique et Activités Biologiques. Tlemcen : s.n., 2012-2013.