Les coronariens ayant une atteinte vasculaire périphérique ont un pronostic cardiovasculaire plus sévère. Il paraît donc intéressant de dépister cette association, notamment en mesurant l’index de pression systolique qui est un moyen simple, non invasif, et non couteux ayant un apport diagnostic important, afin de détecter des lésions silencieuses,
R. Merghit1, A. Trichine1, M. Ait Athmane2, A. Lakehal3
1 Service de Cardiologie, Hôpital militaire Ali Mendjli, Constantine,
2 Service de Cardiologie, CHU de Annaba,
3 Service d’Épidémiologie, CHU de Constantine.
Date de soumission : 28 Mai 2020.
Résumé : Introduction. Les coronariens ayant une atteinte vasculaire périphérique ont un pronostic cardiovasculaire plus sévère. Il paraît donc intéressant de dépister cette association, notamment en mesurant l’index de pression systolique qui est un moyen simple, non invasif, et non couteux ayant un apport diagnostic important, afin de détecter des lésions silencieuses, mais menaçantes, et d’identifier un sous-groupe de coronariens à plus haut risque cardiovasculaire, nécessitant une prise en charge plus spécifique. Objectifs. Estimer la fréquence de l’AOMI[1] chez les patients coronariens, recrutés en cardiologie dans les centres hospitalo-universitaires de la ville de Constantine et déterminer les facteurs de risques de l’association. Patients et méthodes. Notre étude est descriptive, transversale, multicentrique réalisée en unités d’explorations cardiovasculaires de l’hôpital militaire régional universitaire de Constantine. Les sujets inclus avaient aux moins une lésion coronaire significative ≥ 50% sur une artère coronaire principale, pour chaque patient ; une anamnèse orientée et un examen clinique cardiovasculaire ont précédé la mesure de l’IPS. Un complément d’exploration écho-doppler des membres inférieurs a été réalisé pour l’ensemble des malades. L’AOMI était définie par un IPS inférieur à 0,90 sur une des quatre artères distales des membres inférieurs. L’ensemble de non malades ont bénéficié d’une échocardiographie cardiaque avec étude de la fonction diastolique et systolique. Le traitement et l’exploitation des données ont fait appel au logiciel SPSS 22. Résultats. Trois cents patients coronariens, âgés en moyenne de 61 ans à prédominance masculine nette, ont été inclus. La fréquence de l’association AOMI et coronaropathie était de 34,7% en utilisant l’IPS, asymptomatique dans 18% des cas. L’âge ≥ 65 ans, le tabac, le diabète, l’HTA, la dyslipidémie, la sédentarité, l’AVC et l’atteinte coronaire sévère étaient les facteurs indépendants de l’association (ORa respectifs : 3,67 ; 4,10 ; 3,48 ; 3,30 ; 2,32 ; 2,14 ; 6,40 ; 2,36). Conclusion. L’IPS, en plus d’être un outil de dépistage précoce de l’AOMI, sa diffusion en pratique médicale aiderait à l’approche et l’affinement du risque vasculaire des patients coronariens.
Mots clés : AOMI, IPS, Coronaropathie, tabac.
Abstract: Background. Coronary artery disease (CAD) with peripheral artery disease (PAD) has a more severe cardiovascular prognosis. It seems interesting to detect this association, in particular by measuring the ankle brachial index (ABI) which is a simple, accessible and inexpensive way to assess the severity of atheromatous disease of the two lower limbs, in order to detect silent but threatening lesions, and to identify a subgroup of coronary patients with a higher cardiovascular risk, requiring more specific management. Aims. Estimating the frequency of AOMI in coronary patients, recruited in cardiology in Constantine University Hospital Centres and determining the risk factors of the association. Methods. The study is descriptive, cross-sectional recruitment, carried out in cardiovascular exploration units of the Constantine University Military Regional Hospital, the subjects included had at least a significant coronary lesion ≥ 50 on a main coronary artery, for each patient, an oriented anamnesis and a cardiovascular clinical examination preceded the measurement of ABI. A complement of exploration echo-doppler of the lower limbs was performed for all of the patient. .The diagnosis of PAD was defined as an ABI below 0.9 on one of the four distal lower limb arteries. The SPSS 22 software, was used in the processing of data. Results. Three hundred coronary patients were included, average age 61 years, with a clear male predominance, the frequency of the association PAD and CAD was 34.7% using ABI, The PAD was asymptomatic in 18% of cases. Age ≥ 65 years, smoking, diabetes, hypertension, dyslipidaemia, sedentary lifestyle and severe coronary disease were the independent factors of association (respective ORa: 3.67, 3.48, 3.30, 4.10, 2.32, 2.14, 6.40, 2.36). Conclusion. PAD is common in our coronary population, hence the importance of screening for PAD in coronary patients by IPS to identify a subgroup of people with a risk of cardiovascular events. In addition to being an early screening tool for AOMI, the dissemination of ABI measurement in medical practice would help in this approach and refinement of the vascular risk of coronary patients.
Keys Word: PAD, ABI, Coronary Artery Disease, tobacco.
Introduction
L’athérosclérose et son corollaire l’athérothrombose sont répandues, aussi bien dans les pays développés que dans les pays en voie de développement [1]. Elles sont à l’origine d’une morbi-mortalité élevée, constituant ainsi un véritable enjeu en termes de santé publique. Le mode d’entrée dans la maladie athéromateuse peut varier d’un sujet à l’autre avec un événement coronarien comme première manifestation ou encore une atteinte neuro-vasculaire, voire une AOMI, et la liste n’est pas limitative [2]. Recherchée par la mesure de l’IPS, chez des patients coronariens, la prévalence de l’AOMI peut atteindre plus de 30% en fonction de l’âge des sujets et peut même dépasser 40% chez des sujets hospitalisés[3]. Ces coronariens ayant une atteinte vasculaire périphérique ont un pronostic cardiovasculaire plus sévère [3].
Population et méthodes
Population : afin de démonter l’intérêt d’une approche « pan-vasculaire » de tous patients à risque, donc d’essayer de rechercher les autres atteintes athéromateuses souvent asymptomatiques, mais qui peuvent constituer une réelle menace sur le pan fonctionnel ou vital ; nous avons procédé à une étude épidémiologique, descriptive, analytique et multicentrique,% menée sur un échantillon de 300 malades coronariens avérés, au niveau des trois services de cardiologie, des CHU de la ville de Constantine, ayant au moins une lésion ≥ 50% sur une artère coronaire principale, quel que soit leur âge et leur sexe, on excluant ceux ayant refusé de participer à l’étude, et les patients en ischémie aiguë des membres inférieurs. Le consentement éclairé et l’engagement du patient pour ce projet sont requis, en respectant l’anonymat.
Méthodes : Le jour de la vacation, les patients inclus ont bénéficié d’un recueil des mesures anthropométriques (poids, taille, calcule du BMI), un recueil d’information (FRCV, pathologie cardio-cérébro-vasculaire), un examen clinique complet, un bilan biologique incluant le bilan lipidique complet (HDLc, CHOLt, TG, LDLc), une glycémie à jeun, un taux de créatinine et calcul de la clairance de créatinine selon la formule MDRD et un taux HbA1c pour les patients diabétiques. Une mesure de l’index de pression systolique à la cheville (IPSch) en décubitus dorsal, les membres inférieurs et supérieurs dévêtus, chez un patient détendu depuis plus de 10 minutes, un doppler de poche, de marque EDAN Sonotrax Vascular Lite, muni d’une sonde de 8 MHz mis en marche en 2013, avec un tensiomètre à sphygmomètre de marque RIESTER, ont été utilisés. Le brassard est positionné autour de la cheville, avec son bord inférieur en position sus-malléolaire, manchette enroulée sur elle-même, de largeur entre 1,2-1,5 fois le diamètre du segment de membre, les tuyaux sortant vers le haut, la sonde Doppler inclinée, de manière à respecter au mieux un angle de 45 à 60° avec l’axe présumé de l’artère examinée. Après l’obtention d’un signal Doppler stable, le brassard est gonflé de 20 mm Hg au-delà de la pression de disparition du signal, puis dégonflé lentement de 2 mm Hg par seconde jusqu’à réapparition d’un signal audible. La valeur retenue équivaut à la pression artérielle systolique de cheville. Les artères enregistrées sont classiquement, pour chaque membre inférieur, l’artère tibiale postérieure dans la gouttière rétro-malléolaire, l’artère pédieuse au niveau du coup de pied [5].
La manœuvre est réalisée à deux reprises sur chaque membre ; à chaque bras, le signal Doppler est capté au niveau huméral ou radial, avec le brassard positionné comme lors d’une mesure de la PA habituelle. Nous avons choisi la méthode la plus sensible pour calculer L’IPS ; c’est à dire le rapport entre le plus bas niveau de pression systolique (ATP, ADP) sur la pression systolique brachiale la plus élevée des deux bras. L’IPS été calculé pour chacune des artères de chaque membre [6]. L’index le plus bas des deux membres inférieurs est celui qui est considéré, posant le diagnostic d’AOMI si inferieur ou égale 0,9 en présence ou en absence de symptomatologie. Si IPSch est limite entre 0,91 -0,99 ; une épreuve hémodynamique de marche sur tapis roulant (épreuve de Skinner Strandness), avec prise des pressions distales au repos et après effort a été indiquée, à la recherche d’une AOMI infra-clinique, dont le diagnostic est retenu chaque fois que la pression distale chute d’au moins 20% dès la première minute après l’arrêt de l’effort. Dans le cas où l’IPSch est strictement supérieur à 1,3 ; un complément d’exploration hémodynamique par la mesure de l’IPSo pour chaque membre à l’aide d’un photoplethysmographe (Systoe) a été réalisé, évoquant une AOMI si IPSo ≤ 0,7. L’ensemble de non malades ont bénéficié d’une échocardiographie cardiaque avec étude de la fonction diastolique et systolique.
Analyse statistique : Les données des patients, ainsi que l’ensemble des examens, étaient réalisés par le même cardiologue (investigateur principal), par la suite enregistrés initialement sur une fiche de données établie à cet effet, transférée plus tard dans une base de données (fichier EXCEL 2013) conçue dans le même but. L’analyse statistique est effectuée à l’aide du logiciel SPSS 22. Les résultats sont présentés avec des intervalles de confiance à 95%, sous forme de moyenne, médiane, écart-type, et les valeurs minimums et maximums, pour les variables quantitatives ; sous forme de pourcentages avec leur écart-type pour les variables qualitatives. La fréquence observée est calculée par le nombre de coronariens présentant une AOMI, sur le nombre total de la population recrutée, évaluée avec un intervalle de confiance de 95%. Les tests de comparaisons utilisés sont :
- Le test du Chi–deux de Pearson et le test exact de Fisher pour les comparaisons de pourcentages
- Les tests de Student ou de Mann-Whitney pour les comparaisons de moyennes.
- Le seuil de significativité statistique est considéré atteint quand le risque d’erreur est inférieur à 5% (p<0,05).
Résultats
Entre juin 2015 et mars 2016, nous avant collecté 300 malades coronariens (Tableau 1). L’âge moyen de cette population était de 61,3 ± 11,3 ans avec des extrêmes d’âge allant de 23 ans à 85 ans, et une médiane de 62 ans, à prédominance masculine significative (78,3%), cette population était relativement mince (BMI moyen 27,92 ± 4,66 kg/m2, tour de taille moyen 95,55 ± 11,20 cm). La majorité de nos coronariens cumulent plus de trois FRCV (72,7%). Les FRCV prédominants étaient l’âge (69%), suivis par l’HTA (58,7%), la sédentarité (57,3%), la dyslipidémie (52,7%), la surcharge pondérale (49%), et le diabète (47,4%). Les FRCV les moins observés étaient le tabagisme actif (32,3%), l’obésité (29,3%), et les antécédents familiaux de MCV précoces (26,4%). Le diabète s’associe respectivement à l’HTA et la dyslipidémie dans 36%, 47,3% des cas ; la triple association est observée dans 37,7%. Les antécédents personnels de maladies cérébro-vasculaires (AVC ischémique, AVC hémorragique, AIT), étaient observés dans 2,7%. La majorité de nos malades (60,7%) ont été coronarographiés pour un SCA, le reste pour une cardiopathie ischémique stable. Une masse ventriculaire gauche augmentée, mesurée selon la méthode (ASE), est retrouvée dans 54%. La fraction d’éjection globale, selon la méthode biplan Simpson, est conservée dans 83,34% ; et 54,3% de nos malades présentaient une altération de la fonction diastolique VG. 41,67% avaient une atteinte mono-tronculaire, 30,7% bi-tronculaire et 22% d’atteinte tri-tronculaire, l’atteinte du tronc commun gauche est observée chez 5,6%.
Tableau 1 : caractéristiques de notre population
|
VARIABLES |
RESULTAT (n ou%) |
|
Âge moyen |
61,3 ± 11,3 ans |
|
Sexe ratio H/F |
3,6 |
|
Nombre moyen de FRV |
4,09 |
|
Nombre ≥ trois FRCV |
72,7% |
|
Âge ≥ 50ans (H) et ≥ 60ans (F) |
69% |
|
HTA |
58,7% |
|
Sédentarité |
57,3% |
|
Dyslipidémie |
52,7% |
|
Surcharge pondérale |
49% |
|
Diabète |
47,4% |
|
Tabagisme actif |
32,3% |
|
Obésité |
29,3% |
|
Obésité androïde |
32% |
|
Coronaropathie familiale |
26,4% |
|
IRC |
Légère : 9,7% Modérée : 5% Sévère : 1,3% |
|
ATCDS personnels CV |
2,7% |
|
MVG augmentée |
54% |
|
FE VG globale altérée |
16,6% |
|
PRVG VG altérée |
54,3% |
|
Mono tronculaire |
41,67% |
|
Bi tronculaire |
30,7% |
|
Tri tronculaire |
22%. |
|
Atteinte du TCG |
5,6% |
Pour un effectif de 300 malades et sur la base de quatre IPS pour chacun d’entre eux, nous avons totalisé 1.200 IPS, dont l’IPS moyen était de 1,07 ± 0,26 du côté droit et de 1,08 ± 0,24 du côté gauche. Le profil IPS selon le TASCII et l’AHA [7] était normal chez 44,7%, IPSch ≤ 0,9 évoquant une AOMI chez 17,3%. Un IPSch douteux chez 17%, un IPSch > 1,3 évoquant une incompressibilité artérielle chez 21%. Après mesure de l’IPSch d’effort dans les situations ou l’IPSch est douteux (0,9 < IPS < 1), et mesure de l’index de pression systolique au gros orteil dans les situations ou l’IPSch est > 1,3, le profil IPS définitif de notre population était en faveur de l’absence d’AOMI chez 57%, une mediacalcose observée dans 21%, s’agissant soit d’une mediacalcose isolée (8,3%) ou d’une atteinte mixte (12,7%) et présence d’AOMI chez 34,7% s’agissant soit d’une AOMI isolée, diagnostiquée après mesure de l’IPSch de repos chez 52 malades (17,3%), d’une AOMI diagnostiquée après mesure de l’IPSch d’effort dans les cas douteux chez 14 malades (4,7%), ou d’une atteinte mixte (médiacalcose et AOMI associée) chez 38 malades (12,7%). Au total, l’IPS était pathologique chez 129 coronariens, représentant une fréquence de 43% de la population globale (Tableau 2).
La fréquence de l’association AOMI et coronaropathie, diagnostiquée à l’aide de l’index de pression systolique (IPS), est de 34,7% ± 5,3 ; IC à 95% (29,3% – 40%). Cette population est composée donc de 104 malades dont 48 avec AOMI symptomatique et 56 avec AOM asymptomatique.
Tableau 2 : bilan d’exploration des membres inferieurs
|
Paramètres axes artériels des membres inférieurs |
Pourcentage (%) |
|
IPS moyen de la population globale |
Côté droit : 1,07 ± 0,26 Côté gauche : 1,08 ± 0,24 |
|
IPSch ≤ 0,9 : AOMI isolée |
17,33% |
|
IPSch > 1,3 : IPSo > 0,7 : Mediacalcose isolée |
8,33% |
|
IPSch > 1,3 ; IPSo ≤ 0,7 : AOMI associée à une mediacalcose |
12,7% |
|
0,9 < IPSch < 1 au repos, IPS < 0,9 après effort : AOMI infra clinique |
4,67% |
|
0,9 ≤ IPSch ≤ 1,3 et Épreuve de strendness normale : Absence d’AOMI |
57% |
En analyse bi-variée les différents facteurs corrélés à la survenue d’une AOMI chez le coronariens étaient : le sexe masculin, l’âge ≥ 65ans, le diabète, l’HTA, la dyslipidémie, un BMI normal, l’IR sévère, la sédentarité, les antécédents d’AVC, FE Globale Altérée, des PRVG augmentée, une masse VG augmentée et une atteinte coronaire sévère (Tableau 3,4,5).
Tableau 3: Analyse bi-variée, paramètres cliniques
|
Variables |
Odds Ratio (OR) |
P |
|
Sexe masculin |
2,26 |
0,01 |
|
Âge ≥65ans |
3,89 |
0,0001 |
|
Diabète |
3,11 |
0,0001 |
|
HTA |
3,0 |
0,001 |
|
Tabagisme |
2,44 |
0,001 |
|
Dyslipidémie |
2,32 |
0,001 |
|
BMI Normale |
3,56 |
0,0001 |
|
IR sévère |
1,5 |
0,04 |
|
Sédentarité |
1,9 |
0,007 |
|
AVC |
5,40 |
0,023 |
Tableau 4: Analyse bi-variée, paramètres échographiques
|
Variables |
Odds Ratio (OR) |
P |
|
FE Globale Altérée |
1,8 |
0,03 |
|
PRVG Augmentée |
2,2 |
0,005 |
|
Masse VG augmentée |
2,7 |
0,0001 |
Tableau 5: Analyse bi-variée, paramètres coronarographiques
|
Variables |
Odds Ratio (OR) |
P |
|
Pontage aorto-coronaire |
10,90 |
0,0001 |
|
Atteinte coronaire sévère |
2,361 |
0,001 |
|
Nombre De Gestes |
2,15 |
0,0001 |
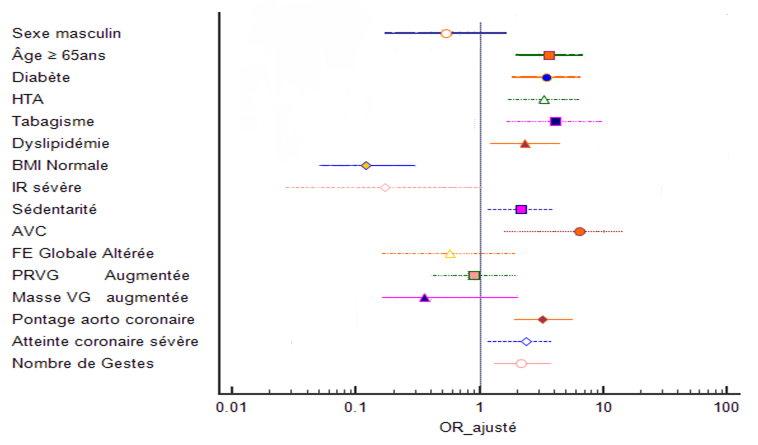
L’analyse multivariée, à type de régression logistique, est réalisée par le logiciel SPSS version 22 ; les variables introduites dans le modèle logistique sont les variables significatives, au seuil de 5%, lors de l’analyse bi-variée. Le risque d’AOMI lié à chaque facteur, ajusté sur l’ensemble des autres facteurs, est représenté par Odds Ratio ajusté (ORa) estimé avec son intervalle de confiance à 95%. Les différents paramètres prédisposant à l’installation de l’AOMI chez le coronarien ont été identifiés grâce à l’analyse multivariée et sont par ordre de fréquence (Tableau 6, Figure 1) : antécédents personnels d’évènements cérébro-vasculaires type AVC ischémique ou AIT (ORa 6,40), le tabagisme (ORa 4,10), l’âge avancé ≥ 65 ans (ORa 3,67), le diabète (3,48), l’HTA (ORa 3,30), une atteinte coronaire sévère (0Ra 2,36), le pontage aorto-coronaire (ORa 3,20), et à un degré moindre la dyslipidémie et la sédentarité (ORa 2,32, 2,14). Cependant, certains facteurs retrouvés significatifs dans l’analyse bi-variée ne ressortent plus dans l’analyse multivariée. Ce sont : le sexe masculin, un BMI normal, l’insuffisance rénale sévère, la dysfonction VG systolique, la dysfonction VG diastolique et la masse VG augmentée.
Tableau 6: Analyse multivariée
|
Variables |
OR ajusté |
IC de l’ORa a 95% |
P |
|
Sexe masculin |
0,53 |
0,172 1,654 |
0,277 |
|
Âge ≥ 65ans |
3,67 |
1,975 6,851 |
0,0001 |
|
Diabète |
3,48 |
1,843 6,589 |
0,0001 |
|
HTA |
3,30 |
1,703 6,406 |
0,0001 |
|
Tabagisme |
4,10 |
1,674 10,069 |
0,002 |
|
Dyslipidémie |
2,32 |
1,234 4,381 |
0,009 |
|
BMI Normale |
0,12 |
0,051 0,293 |
0,0001 |
|
IR sévère |
0,17 |
0,027 1,089 |
0,062 |
|
Sédentarité |
2,14 |
1,159 3,971 |
0,015 |
|
AVC |
6,40 |
1,60 14,20 |
0,0001 |
|
FE Globale Altérée |
0,58 |
0,164 2,025 |
0,390 |
|
PRVG Augmentée |
0,90 |
0,422 1,948 |
0,801 |
|
Masse VG augmentée |
0,36 |
0,164 2,025 |
0,7 |
|
Pontage aorto coronaire |
3,20 |
1,94 5,504 |
0,0001 |
|
Atteinte coronaire sévère |
2,36 |
1,159 3,822 |
0,015 |
|
Nombre de Gestes |
2,15 |
1,32 3,76 |
0,002 |
Figure 1 : Les facteurs prédicteurs de l’AOMI chez notre coronarien
Les principaux résultats de l’étude comparative de nos deux populations de coronariens artéritiques et non artéritiques sont résumés dans le tableau suivant (Tableau 7) :
Tableau 7 : étude comparative de nos deux populations de coronariens
|
Variables |
Coronariens artéritiques (n=104) |
Coronariens non artéritiques (n= 196) |
OR ajusté |
P |
|
Sexe (n -%) -Hommes -Femmes |
90(86,5%) 14(13,5%) |
145(74%) 51(26%) |
0,53 |
0,277 |
|
Age moyen (ans) |
67,24±8,4 |
58,14±11,25 |
3 |
0,0001 |
|
Tranche d’âge (ans) -≥65 -<65 |
68(65,4%) 36(34,6%) |
64(32,6%) 132(67,4%) |
3,67 |
0,0001 |
|
Nombre des FRCV -≥ 3FRCV -< 3FRCV |
94(90,4%) 10(9,6%) |
124(63,3%) 72(36,7%) |
– |
0,0001 |
|
BMI (Kg/m2) -BMI moyen -BMI≥30 (n -%) -BMI<30(n -%) |
26,34 ± 43 10(9,6%) 94(90,4%) |
28,75 ± 4,63 78(39,8%) 118(60,2) |
– 0,12 |
0,0001 0,0001 |
|
Diabète (n-%) Diabétique Non diabétique -Durée moyenne (ans) -Ancienneté diabète (ans) ≥10 (n-%) -HBA1C moyen -Équilibre diabète (n-%) Bon équilibre Équilibre moyen Mauvais équilibre |
68(65,4%) 36 (34,6%) 11,03 ±9,114 35(51,5%) 8,42±1,62 15(27,8%) 12(22,2%) 27(50,0%) |
74(37,8%) 122 (62,2%) 11,74 ± 7,86 43(58,1%) 8,25±1,52 51(58,0%) 11(12,5%) 26(29,5%) |
3,48 – – – – |
0,0001 0,6 0,427 0,5 0,002 |
|
Tabac (n-%) Fumeur Non-Fumeur Durée moyenne de sevrage (ans) Quantité moyenne d’intoxication |
78(75%) 26(25%) 13,97 ± 5,56 37,95 ± 19,36 |
108(55,1%) 88(44,9%) 18,34 ± 11,43 28 ± 17,80 |
4,10 – – |
0,002 0,01 0,002 |
|
HTA (n-%) HTA Absence d’HTA -Durée moyenne (ans) -Ancienneté HTA (ans) ≥10 -Équilibre HTA (n-%) HTA équilibré HTA non équilibré |
78(75,0%) 26(25,0%) 8,18± 8,614 26 (33,3%) 27(34,3%) 51(65,7%) |
98(50,0%) 98(50,0%) 8,16± 6,134 40 (40,8%) 42(42,1%) 57(57,9%) |
3,30 – – – |
0,0001 0,9 0,3 0,003 |
|
Dyslipidémie (n-%) Dyslipidémie Absence de dyslipidémie -LDL Pathologique> 0,7g/L -HDL Pathologique< 0,4g /L |
74(71,2%) 30(28,8%) 56(53,84%) 72(69,2%) |
101(51,5%) 95(48,5%) 86(43,87%) 78(39,8%) |
2,32 – – |
0,009 0,001 0,001 |
|
Coronaropathie familiale (n-%) Coronaropathie familiale Absence de coronaropathie familiale |
28(26,9%) 76(73,1%) |
51(26,0%) 145(74,0%) |
– |
0,5 |
|
IR sévère |
5(4,8%) |
2(1,0%) |
0,17 |
0,062 |
|
Sédentarité (n-%) Sédentarité Absence de sédentarité |
70(67,3%) 34(32,7%) |
102(52,0%) 94(48,0%) |
2,14 |
0,015 |
|
AVC (n-%) AVC Absence d’AVC |
6(5,8%) 98(94,2%) |
2(1,0%) 194(99,0%) |
6,40 |
0,0001 |
|
Présentation clinique de la maladie coronaire (n-%) Angor d’effort SAC ST – SCA ST + Bilan IMS + Bilan CMD |
34(32,7%) 19(18,3%) 42(40,4%) 5(4,8%) 4(3,8%) |
65(33,2%) 46(23,5%) 75(38,3%) 4(2,0%) 7(3,6%) |
– – – – – |
0,5 0,18 0,4 0,63 0,5 |
|
FE Globale Altérée (n-%) FE Globale altérée FE Globale normale |
32(30,77%) 72(69,23%) |
18(9,2%) 178(90,8%) |
0,58 |
0,390 |
|
PRVG (n-%) PRVG élevée PRVG normale |
68(65,4%) 36(34,6%) |
95(48,5%) 101(51,5%) |
0,90 |
0,801 |
|
Masse VG (n-%) Masse VG normale Masse VG augmentée |
33(31,7%) 71(68,3%) |
105(53,6%) 91(46,4%) |
0,36 |
0,7 |
|
Atteinte coronaire sévère (n-%) |
64(61,53%) |
19 (9,70%) |
2,36 |
0,015 |
|
Nombre de Gestes (n-%) |
3,1±0,89 |
1,84±0,79 |
2,15 |
0,002 |
Discussion
L’AOMI est une pathologie dont la prise en charge globale est à l’origine de coûts importants pour la société. Aussi, compte tenu de son impact médico-socioéconomique, les sociétés savantes recommandent son dépistage, afin d’identifier des populations à risque et d’optimiser leur prise en charge thérapeutique. La mesure de l’IPS constitue la pierre angulaire de la stratégie d’exploration artérielle des membres inférieurs, permettant non seulement de faire le diagnostic de l’AOMI dans bon nombre de cas, mais contribue aussi à identifier une frange importante de population asymptomatique, pourtant déjà à haut risque cardiovasculaire. Les études montrent qu’il n’y a pas de différence significative en terme de risque de décès, et d’événements vasculaires, à cinq ans entre les patients symptomatiques et asymptomatiques [8].
Quel que soit le stade de la maladie coronaire, la présence d’une AOMI constitue un facteur de mauvais pronostic tout du moins un facteur aggravant, en tout état de cause, le niveau de risque élevé de ces patients devrait constituer une stimulation pour assurer une prise en charge efficace en privilégiant l’adhérence aux recommandations pour le traitement médicamenteux et les modifications du style de vie [3]. L’IPS représente la méthode d’exploration la plus simple et la plus répandue, pour le diagnostic de l’AOMI, en complément immédiat de l’examen clinique, qui a radicalement transformé la vision de l’AOMI basée sur l’évaluation de la CI. La relative simplicité de ce test, son moindre coût et sa haute sensibilité semblent l’indiquer pour la détection de l’AOMI dans des populations pauci- ou asymptomatiques. Ceci nous a poussé à son utilisation durant notre travail pour poser le diagnostic de l’AOMI, et déduire par la suite la fréquence de l’association avec la coronaropathie, d’autant plus que l’apport des questionnaires (Rose, Édimbourg etc.) et de l’examen clinique pour le diagnostic de l’AOMI sont réduits, comme démontré par de nombreuses études épidémiologiques [9,10,11,12,13,14].
Durant notre étude, a été considéré comme artéritique, tout patient symptomatique ou asymptomatique, avec l’un des critères suivants : un IPSch ≤ 0,9 au repos, un IPSch ≤ 0,9 après sensibilisation à l’effort (test de Skinner Strandness positif) ; ou un IPSo ≤ 0,7 chez un malade ayant un IPSch > 1,3. On se basant sur ces conditions, la fréquence de l’association coronaropathie et AOMI était de 34,7% ± 5,3 ; IC à 95% (29,3% – 40%). Les différentes études objectivent une fréquence élevée de l’AOMI chez les coronariens [3]. Les différents paramètres prédisposant à l’installation de l’AOMI chez notre coronarien étaient les antécédents personnels d’évènements cérébro-vasculaires type AVC ischémique ou AIT, le tabagisme, l’âge avancé ≥ 65ans, l’HTA, une atteinte coronaire sévère, et à un degré moindre, la dyslipidémie et la sédentarité (ORa 2,32,2,14).
Cependant, certains facteurs retrouvés significatifs dans l’analyse bi-variée ne ressortent plus dans l’analyse multivariée comme le sexe ou la différence entre les sexes, semble disparaitre après régression logistique et ajustement aux facteurs confondants, comme l’âge et les FRCV essentiellement le tabac exclusivement masculin dans notre étude. Un BMI normal est plutôt facteur protecteur, ceci semble être en relation avec l’implication de l’obésité dans d’autres facteurs de risque de l’AOMI comme l’hypertension, le diabète de type II et la dyslipidémie. Dans notre étude, la coronaropathie familiale n’était pas corrélée à la survenue d’une AOMI chez le coronarien comme démontré par d’autres études épidémiologiques [15,16,17]. La masse ventriculaire gauche est significativement augmentée dans le groupe artéritique versus groupe non artéritique (P=0,0001). Cette constatation est similaire pour les pressions de remplissage VG (P=0,005), mais il y a disparition de ces liaisons en analyse multivariée. Cette perte de puissance statistique peut s’expliquer par l’intrication de plusieurs facteurs dans l’augmentation de la masse VG (essentiellement l’HTA et le diabète), ainsi que pour les PRVG (l’HTA, le diabète, la masse VG, la coronaropathie). D’après notre analyse, La dysfonction ventriculaire gauche est significativement liée à la survenue d’une AOMI chez le coronarien en analyse bi-variée (P= 0,03). Après analyse multivariée, cette liaison disparait (P value 0,390), probablement en rapport avec la diminution de la puissance statistique de ce facteur après ajustement aux autres facteurs ; essentiellement la maladie coronaire sévère, souvent incriminée dans la dysfonction VG.
Conclusion
Actuellement, l’IPS est reconnu par la majorité des recommandations internationales comme un moyen rapide, de faible coût, non invasif, et reproductible, devant compléter tout examen clinique dans une population ciblée (tout patient présentant au moins un facteur de risque cardio-vasculaire ou chez tout sujet ayant au moins une atteinte vasculaire athérothrombotique), Il doit être à la portée de tout praticien spécialiste ou non, prenant en charge ce type de malade et s’inscrivant dans un bilan vasculaire systématique, pour établir, ou au contraire éliminer, une AOMI symptomatique ou asymptomatique, et d’identifier un sous-groupe de coronariens à plus haut risque cardiovasculaire nécessitant une prise en charge plus spécifique.
Liste des abréviations
AOMI….. Artériopathie Oblitérante des Membres Inférieurs
IPS……… Index de Pression Systolique
FRCV…… Facteurs de Risque Cardiovasculaires
HTA……. Hypertension Artérielle
MCV…… Maladies Cardiovasculaires
SCA…….. Syndrome Coronarien Aigu
PRVG….. Pressions de Remplissage du Ventricule Gauche
AIT……… Accident Ischémique Transitoire
CI……….. Claudication Intermittente
TCG……. Tronc Coronaire Gauche
FE………. Fraction d’Éjection
VG……… Ventricule Gauche
IMS…….. Ischémie Myocardique Silencieuse
CMD…… Cardio Myopathie Dilatée
AVC……. Accident Vasculaire Cérébrale
IRC……… Insuffisance Rénale Chronique
BMI……. Body Mass Index
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- Fowkes, F.G., et al., Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: a systematic review and analysis. Lancet, 2013. 382(9901): p. 1329-40.
- Becker, F., Artériopathie oblitérante des membres inférieurs. Journal des Maladies Vasculaires, 2016. 41(2): p. 96.
- Aboyans, V., et al., Stratégie de la conduite des examens chez le patient polyvasculaire, in EMC – Angiologie VL – IS – SP – YP -. 2016.
- European Stroke, O., et al., ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: The Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J, 2011. 32(22): p. 2851-906.
- Hiatt, W.R., Medical treatment of peripheral arterial disease and claudication. N Engl J Med, 2001. 344(21): p. 1608-21.
- Espinola-Klein, C., et al., Different calculations of ankle-brachial index and their impact on cardiovascular risk prediction. Circulation, 2008. 118(9): p. 961-7.
- Haute Autorité de Santé (HAS). Recommandations pour la pratique clinique : Prise en charge de l’artériopathie chronique oblitérante athéroscléreuse des membres inférieurs (indications médicamenteuses, de revascularisation et de rééducation). 2006; Available from: undefined
- Golomb, B.A., T.T. Dang, and M.H. Criqui, Peripheral arterial disease: morbidity and mortality implications. Circulation, 2006. 114(7): p. 688-99.
- Yao, S.T., J.T. Hobbs, and W.T. Irvine, Ankle systolic pressure measurements in arterial disease affecting the lower extremities. Br J Surg, 1969. 56(9): p. 676-9.
- Newman, A.B., et al., Ankle-arm index as a predictor of cardiovascular disease and mortality in the Cardiovascular Health Study. The Cardiovascular Health Study Group. Arterioscler Thromb Vasc Biol, 1999. 19(3): p. 538-45.
- Vogt, M.T., S.K. Wolfson, and L.H. Kuller, Lower extremity arterial disease and the aging process: a review. J Clin Epidemiol, 1992. 45(5): p. 529-42.
- Newman, A.B., et al., The role of comorbidity in the assessment of intermittent claudication in older adults. J Clin Epidemiol, 2001. 54(3): p. 294-300.
- Khan, N.A., et al., Does the clinical examination predict lower extremity peripheral arterial disease? JAMA, 2006. 295(5): p. 536-46.
- McGee, S.R. and E.J. Boyko, Physical examination and chronic lower-extremity ischemia: a critical review. Arch Intern Med, 1998. 158(12): p. 1357-64.
- Nadjia, K.H., Prévalence de L’artériopathie oblitérante des membres inférieurs chez le coronarien Algérien. (Doctoral dissertation, Université Benyoucef Benkhedda Alger 1), 2013.
- Aboyans V, L.P., Postil A, Guilloux J, Rollé F, Cornu E, et al, Subclinical peripheral arterial disease and incompressible ankle arteries are both long-term prognostic factors in patients undergoing coronary artery bypass grafting. J Am Coll Cardiol, 2005. 46:815–20.
- Bertomeu V, M.P., Gonzalez-Juanatey JR, Quiles J, Guindo J, Soria F et al., Prevalence and Prognostic Influence of Peripheral Arterial Disease in Patients>40 Years Old Admitted into Hospital Following an Acute Coronary Event. Eur J Vasc Endovasc Surg., 2008; 36: 189-96.
[1] Voir la liste des abréviations à la fin de l’article.