La surcharge en fer (hémosidérose) secondaire post-transfusionnelle est fréquemment observée chez les patients β-thalassémiques majeurs (β-TM) polytransfusés. L’hémosidérose pancréatique commence chez ces patients, après la première décennie de la vie et l’incidence de ces complications augmente avec l’âge.
S. Khensal, K. Benmohammed, Service d’endocrinologie CHU Abdesselam Benbadis, Constantine.
Date de soumission : 09 Août 2020.
Abstract : La surcharge en fer (hémosidérose) secondaire post-transfusionnelle est fréquemment observée chez les patients β-thalassémiques majeurs (β-TM) polytransfusés. L’hémosidérose pancréatique commence chez ces patients, après la première décennie de la vie et l’incidence de ces complications augmente avec l’âge. Les anomalies de l’homéostasie du glucose sont des complications assez courantes ; le diabète sucré (DS) est rare au cours des premières années de vie. L’intolérance au glucose (IG), quant à elle, peut commencer au début de la deuxième décennie, parallèlement à la puberté. L’étiologie du DS chez les patients TM est multifactorielle. Elle a été principalement attribuée à une surcharge en fer pancréatique liée à la transfusion sanguine au long cours, entraînant la destruction des cellules β du pancréas sécrétant de l’insuline et une hémosidérose hépatique entraînant une résistance à l’insuline. D’autres facteurs tels que l’infection virale (l’hépatite C), l’auto-immunité, les antécédents familiaux de DS et les facteurs génétiques jouent également un rôle important. L’espérance de vie des patients β-TM ayant considérablement augmenté, fait que le contrôle glycémique optimal devienne important afin de réduire le risque de complications diabétiques. La reconnaissance précoce des anomalies du métabolisme du glucose est essentielle pour la prévention, la détection et la prise en charge précoce du diabète. Cette mise au point vise à mettre à jour les connaissances actuelles sur les anomalies glycémiques chez les patients β-TM présentant soit une IG ou DS et attire l’attention sur diagnostic et prise en charge adéquate.
Mots clés : Bêta-thalassémie majeure, surcharge en fer, anomalies de la tolérance glucosée, prévention.
Abstract: Iron overloading is frequently observed in patients with transfusion therapy in ?-thalassemia major (β-TM). Pancreatic iron loading in these patients begins after the first decade of life and the incidence of complications increases with age. Abnormalities in glucose homeostasis are fairly common complications, Diabetes Mellitus (DM) is uncommon during the first years of life. Impaired glucose tolerance may start early in the second decade, parallel to puberty. The aetiology of DM in patients with β-TM is multifactorial. It has been predominantly attributed to transfusion-related pancreatic iron overload resulting in destruction of insulin secreting β-cells of the pancreas and liver hemosiderosis leading to insulin resistance. Other factors such as hepatitis C viral infection, autoimmunity, family history of DM and genetic factors also play an important role. As life expectancy in patients with β-TM has risen substantially, optimal glycaemic control is becoming extremely important in order to reduce diabetic complications risk. Early recognition of glucose abnormalities is essential for the prevention, detection and early management of diabetes complications and this review updates the current knowledge about glycaemic abnormalities in TM patients (impaired glucose tolerance and diabetes) and directs attention to early diagnosis and proper management.
Keys words: ?-thalassemia major, Iron overload, Glucose homeostasis.
Introduction
La bêta thalassémie est une anémie hémolytique héréditaire due à des anomalies des gènes de l’hémoglobine (Hb). L’état homozygote, connu sous le nom bêta-thalassémie majeure (β-TM), très répandu auparavant en Méditerranée et dans les pays du Moyen-Orient est devenu actuellement un problème de santé mondial du fait des phénomènes migratoires (1). Elle entraîne une hémolyse sévère dès la petite enfance, nécessitant un régime transfusionnel et un traitement chélateur du fer au long cours. La surcharge cardiaque en fer qui en résulte, reste la principale cause de mortalité en bas âge.
L’espérance de vie dans la β-TM a considérablement augmenté au cours de la dernière décennie, en raison de l’amélioration des soins médicaux, particulièrement la chélation du fer guidée par le dosage de la ferritine sérique (FS), et l’imagerie par résonance magnétique (IRMT2 *) (2-4). Avec une durée de vie plus longue, d’autres morbidités non cardiaques dues à la surcharge en fer émergent, notamment les complications endocriniennes et les anomalies de la tolérance glucosée (5).
Le DS est une endocrinopathie fréquente, dont la physiopathologie dans la TM est multifactorielle, la surcharge en fer en est sa principale cause, et sa gestion pose un véritable défi aux cliniciens (6,7). Ces anomalies glycémiques ont été documentées principalement dans la 2ème et la 3ème décade de la vie présentant un risque potentiel supplémentaire d’altération de la fonction cardiaque (5,8).
- Les facteurs de risques de développement du DS dans la TM sont :
- Les facteurs génétiques
- La mise en route tardive de la chélation,
- Une mauvaise observance du traitement chélateur, l’inadéquation du dosage, les propriétés chimiques de l’agent chélateur et
- Les altérations hépatiques (hépatite chronique ou cirrhose).
Données épidémiologiques des anomalies glucidiques au cours de la TM
La prévalence du DS et de l’IG chez les adolescents et les jeunes adultes TM traités conventionnellement à la déféroxamine (DFO) est fortement corrélée à la concentration de FS (9,10).
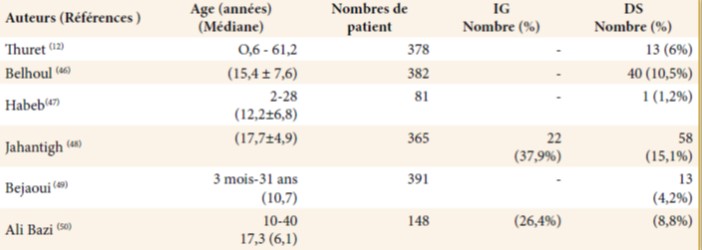
Elle varie dans de différentes séries de 0 à 10,5% (6,11) et de 17 à 24% (8,10) respectivement (tableau 1). L’IG est plus précoce que la survenue d’un diabète franc, qui lui, concerne 5 à 10% des patients adultes (12,13). Quant à la prévalence du diabète insulinodépendant (DID), celle-ci a régressé depuis la mise en route précoce du traitement par DFO. Cette forte variabilité pourrait s’expliquer par des facteurs ethniques, par l’âge de mise en route de la chélation du fer ainsi que de la régularité de sa prise. Par ailleurs, certains auteurs notent une forte corrélation entre le diabète et la présence de complications endocriniennes associées comme l’hypogonadisme, la présence d’hépatite C, le statut économique et la sévérité de l’anomalie génétique (14-16).
Tableau 01 : Prévalences des anomalie glucidiques chez les patients TM
Physiopathologie du diabète dans la thalassémie
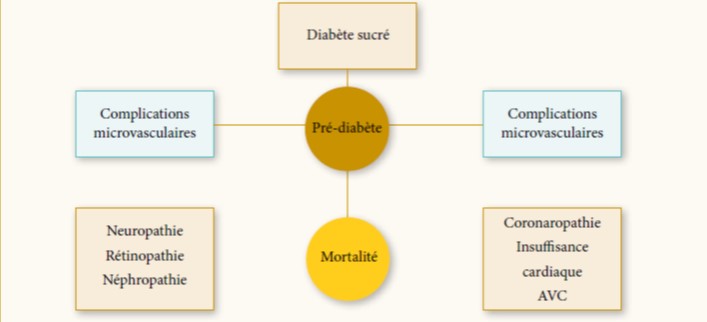
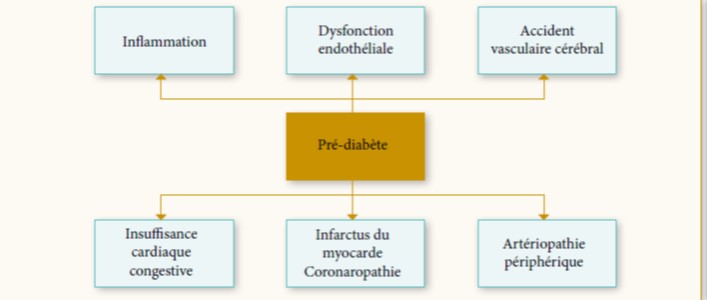
La pathogenèse du DS dans la TM n’est pas entièrement élucidée mais il semblerait que « l’agression initiale » soit liée à l’insulinorésistance (IR) plus qu’à l’altération de la production d’insuline (17). Dans un 2ème temps, les lésions des cellules β et le défaut de production d’insuline s’installent et sont la conséquence finale des dépôts de fer dans le pancréas (18) (figure 1). En effet, l’hémosidérose pancréatique produit un stress oxydatif dans les cellules ß. Ceci est suivi par l’apoptose cellulaire due à la transformation des graisses in situ, la réduction du volume du pancréas et son dysfonctionnement. En outre, il est postulé que l’insuffisance hépatique peut interférer avec la capacité de l’insuline à supprimer l’absorption du glucose hépatique de même que la surcharge en fer dans les muscles peut diminuer l’absorption du glucose périphérique. Avec l’âge, la persistance de l’IR épuise les cellules β et réduit la sécrétion d’insuline. Cette hypothèse est étayée par plusieurs études montrant une augmentation des taux d’insuline plasmatique à jeun avec une augmentation de l’IR en présence d’abord d’une glycémie normale avant l’apparition de l’IG puis du DS (19).
Par ailleurs, on suppose que l’interaction entre la sidérose hépatique et l’hépatite C facilite et accélère la progression précoce vers le DID (20). En outre, la carence en zinc pourrait conduire à une incapacité du pancréas à sécréter des quantités suffisantes d’insuline en réponse à la charge de glucose par voie orale chez les patients TM (21,22).
Une autre étiologie proposée pour expliquer les anomalies glucidiques dans la TM est l’induction d’une auto-immunité contre les antigènes des cellules ß détruites. Cette théorie suppose que le dépôt de fer, par le biais de dommages oxydatifs, agit comme un facteur environnemental qui déclenche la réponse auto-immune contre les cellules β et contribue par conséquent à une lésion sélective des cellules β. Une étude italienne a détecté la présence d’anticorps de cellules d’îlots, d’auto-anticorps anti-glutamate décarboxylase, d’auto-anticorps anti-insuline et d’anticorps antinucléaires sériques chez certains patients TM diabétiques (23). D’autres études sont nécessaires pour explorer le rôle de l’auto-immunité chez les sujets TM.
De plus, avec l’épidémie mondiale de diabète, les patients TM pourraient développer un DT1 ou 2, indépendamment de leur thalassémie (19).
L’intervalle entre le diagnostic d’IG et le développement d’un DID a été estimé de trois à dix ans (6, 24).
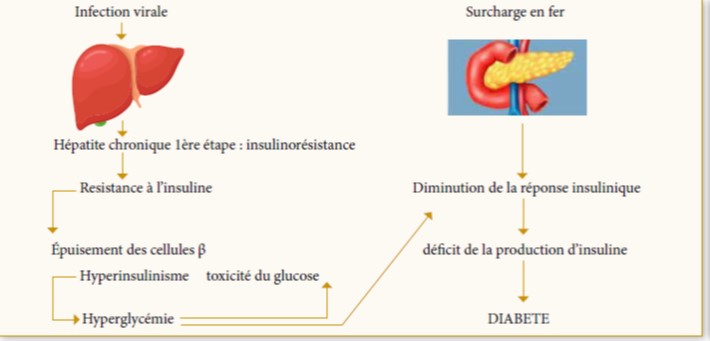
Figure 1 : Physiopathologie des anomalies glucidiques dans la thalassémie (18)
Diagnostics des troubles de la tolérance glucosée dans la TM
La charge martiale pancréatique est le « prédicteur » le plus significatif de toxicité sur les cellules β. Elle peut être évaluée précocement par l’IRM pancréatique bien que cette technique ne soit pas standardisée pour la pratique clinique (25). L’IRM et le dosage de la glycémie et de l’insulinémie à jeun sont des outils complémentaires qui pourraient identifier les patients à risque de présenter un diabète avant la survenue des lésions irréversibles(26). Bien que la méthode la plus précise pour évaluer l’altération du métabolisme du glucose chez les patients TM reste encore controversée, l’hyperglycémie provoquée par voie orale (HGPO) reste pour certains, le gold standard. Cependant, d’autres auteurs reprochent à l’HGPO de manquer les épisodes d’hyperglycémie et lui préfèrent la mesure continue de glucose (CGMS) qui semble être un outil valide pour détecter les anomalies précoces de la tolérance glucosée (27,28) (Tableau 2).
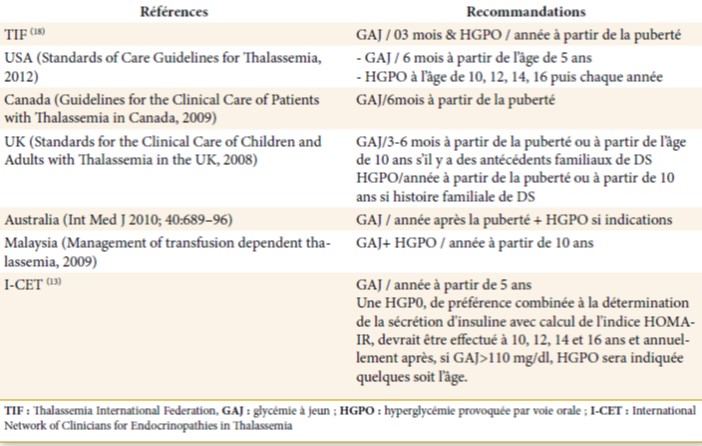
Tableau 02 : Les recommandations internationales pour le dépistage des anomalies de tolérance dans la TM (13)
Critères de diagnostic du diabète sucré et du prédiabète, et implications chez les patients TM
Selon les recommandations de « The International Network of Clinicians for Endocrinopathies in Thalassemia and Adolescent Medicine » (ICET-A), les critères de diagnostic du DS et du prédiabète chez patients TM obéissent aux directives actuelles de l’American Diabetes Association (ADA), cependant certaines particularités liées à la TM doivent être soulignées (13,16).
Les critères diagnostics du diabète sucré sont
- Une glycémie à jeun ≥126 mg/dl (7,0 mmol/L), ou
- Lors d’une HGPO, une glycémie sérique à 2 heures ≥200 mg/dl (11,1 mmol/L), pose le diagnostic de diabète. Le test doit être effectué comme décrit par l’OMS, en utilisant une charge de glucose contenant l’équivalent de 75 g de glucose dissous dans l’eau, ou
- HbA1C ≥6,5% (48 mmol/mol), effectuée en utilisant la méthode certifiée NGSP (National Glycohemoglobin Standardization Program) et normalisée selon le test DCCT (Diabetes Control and Complications Trial), ou
- Chez un patient présentant des symptômes classiques d’hyperglycémie, une glycémie plasmatique aléatoire ≥200 mg/dL (11,1 mmol/L).
Critères du risque de prédiabète :
- Glycémie à jeun entre 100 mg/dL et 125 mg/dL (5 – 6 mmol/L).
- Glycémie, après HGPO, entre 140 mg/dL (7,8 mmol/L) et 199 mg/dL (11,0 mmol/L).
- HbA1c entre 5,7 et 6,4% lors d’une HGPO une glycémie sérique à 2 heures >140 <200 mg/dl pose le diagnostic d’intolérance au glucose.
Dans la TM, la ‘’crédibilité’’ de l’HbA1c en tant que ‘’gold standard’’ pour le diagnostic et le contrôle du DS est remise en question. En effet, son dosage étant basé sur l’Hb normale peut être affecté par la présence d’hémoglobinopathies de trois manières (29) :
- Modification du processus normal de glycation de l’HbA en HbA1C,
- Genèse d’un pic anormal en chromatographie,
- Les globules rouges (GR) dans la TM sont plus sujets à l’hémolyse, réduisant ainsi le temps de glycosylation avec un résultat d’HbA1C faussement bas. Ceci peut être expliqué par le fait que la composition en Hb des hématies des patients TM est considérablement modifiée. En raison des transfusions fréquentes et régulières, les érythrocytes du patient TM sont un mélange de GR transfusés provenant de donneurs ayant une composition normale d’Hb, avec une Hb A d’environ 95% et une Hb F de 2 à 3%. Les érythrocytes de stockage ont des différences fonctionnelles et métaboliques ainsi qu’une durée de vie considérablement plus courte que les GR sains (9,30,31). D’autre part, les résultats d’une étude récente, menée par Kattamis et al., ont montré que le dosage de l’HbA1c avant la transfusion serait un indice fiable de la concentration moyenne de glucose pour la période entre les transfusions allant de 2 à 4 semaines et jusqu’à 40 jours, un seuil >7% suggérerait le DS, et des valeurs comprises entre 6 et 7% un prédiabète (32). D’autres études sont nécessaires pour confirmer ces observations.
Les experts de (ICET-A) recommandent également :
- La pratique d’une glycémie à jeun deux fois par an : si celle-ci est >110 mg/dl, l’HGPO est indiquée.
- Une HGPO, de préférence combinée à la détermination de la sécrétion d’insuline avec calcul de l’indice HOMA-IR (Homeostasis Model Assessment of insulin resistance), devrait être effectué à 10, 12, 14 et 16 ans et annuellement après (5,29).
- L’indice de HOMA-IR est calculé selon la formule suivante :
Insulinémie à jeun (µUI/ml ou mUl/l x glycémie à jeun (mmol/l) /22,5
Il s’agit d’une méthode validée, largement utilisée pour l’estimation de l’IR, cependant, il y a un manque de valeurs de référence consensuelles pour les patients thalassémiques. Singh Y et al., ont démontré que le seuil de 2,5 fournit une sensibilité et une spécificité maximales dans le diagnostic du syndrome métabolique dans les deux sexes (16,33).
Une comparaison de certaines caractéristiques du DS dans la TM avec d’autres formes de DS sont indiquées dans le tableau 3.
Tableau 3. Comparaison du DS dans la TM avec d’autres formes de diabète(16)
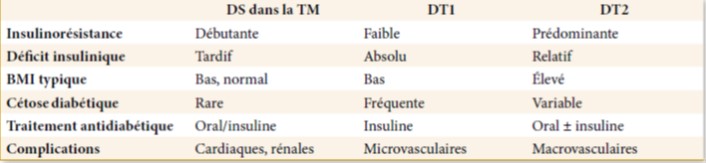
Le DID dans la TM présente des caractéristiques inhabituelles par rapport au DT1 (9,10) :
- L’acidocétose est rare,
- Le seuil de glucose rénal est élevé,
- Les anticorps des cellules des îlots sont souvent négatifs et
- Il n’y a pas d’association avec les haplotypes HLA B8-DR3, BW15 et DR4.
Prise en charge :
Une équipe multidisciplinaire (hématologues, endocrinologues, cardiologues, diététiciens et psychologues) est d’une importance capitale pour la prise en charge individualisée des patients TM diabétiques. La prise en charge de l’IG et du DS dans la TM est basée sur deux grands chapitres :
- Prise en charge de la TM: Optimisation du traitement conventionnel de la TM basée sur :
- La transfusion régulière de 10-20 ml/kg de GR filtrés sur une période de 2-3 h toutes les 2 à 5 semaines est recommandée pour traiter l’anémie chronique en visant des taux d’hémoglobine pré-transfusionnelle > 9,5 g/dl(5).
- Le traitement chélateur intensif combiné : l’association de DFO et de défériprone permet d’améliorer la tolérance au glucose, en particulier aux stades précoces de l’IG et de diminuer l’insulinorésistance, et parfois prévenir l’apparition du diabète (34-36).
- Traitement du DS : Dans le diabète déclaré, le traitement médical dépend de la gravité des lésions des cellules β et du degré de la déficience en insuline, il repose sur les éléments suivants :
- Le régime diabétique : Des évaluations nutritionnelles régulières doivent être effectuées, en insistant sur le comptage des glucides, des aliments contenant du fer, de la vitamine D, du calcium et du zinc.
- L’activité physique régulière afin d’améliorer la sensibilité à l’insuline.
- Le traitement anti diabétique oral (ADO) : bien qu’il existe peu de données publiées sur l’efficacité et l’innocuité des ADO dans la TM, une approche pas à pas utilisant d’abord le régime et l’exercice physique, suivie d’une monothérapie orale à base de metformine puis de l’association metformine plus sulfamide hypoglycémiant ou gliptines, est suggérée au stade d’IR (37). En général bien tolérée, la metformine assure un bon contrôle glycémique sur 24 mois en moyenne, justifiant pour certains son utilisation même au stade de prédiabète dans la TM (38,39).
- L’acarbose utilisé également comme traitement de première intention pour le contrôle glycémique chez les patients en hyperinsulinisme, à la dose de 100 mg après les principaux repas(40).
- L’insulinothérapie est envisagée au stade de la carence en insuline, son initiation et son intensification doivent être prudentes car il a été rapporté que certains patients thalassémiques peuvent développer une insuffisance cardiaque par rétention hydrique (41).
- Le monitoring du contrôle glycémique chez les patients TM n’est pas différent de celui de la population générale diabétique (13) : la mesure continue de glucose (CGMS) est actuellement à privilégier.
- Les objectifs glycémiques sont similaires à ceux de la population diabétique non thalassémiques.
- Recherche des cétones urinaires si la glycémie sanguine > 250 mg/ml.
- Dosage de la fructosamine mensuelle : Les taux sériques de fructosamine ont été proposés comme moyen de suivi du contrôle glycémique à long terme chez les patients TM diabétiques.
- La prévention et traitement de l’hépatite C.
- Complications : Le diabète dans la thalassémie augmente considérablement le risque de complications cardiaques (arythmies hyperkinétiques et fibrose myocardique), de même que la prédisposition au développement de la néphropathie diabétique (du fait du stress oxydatif), et impose une surveillance étroite de la fonction cardiaque et rénale (42,43), en revanche les patients TM semblent être protégés contre la rétinopathie diabétique (faibles taux d’IGF1) (44).
Cas particulier de la femme enceinte
Selon les recommandations de l’ICET-A sur la prise en charge du DS et de ses complications chez les femmes TM qui souhaitent concevoir et celles qui sont déjà enceintes, il ressort que les femmes TM avec une tolérance glucosée normale doivent toujours être informées du risque de développer une IG et que l’HGPO répétée doit être effectuée aux 12-16 et 24-28 semaines de gestation avec des mesures à 0, 1 et 2 h (critères spécifiques de diabète gestationnel).
Quant aux femmes diabétiques TM qui ont un projet de grossesse, elles doivent être informées qu’un bon contrôle glycémique avant la conception, et durant la grossesse réduirait le risque de fausse couche, de malformation congénitale, de mortinatalité et de décès néonatal (risque multiplié par quatre d’anomalie fœtale et multiplié par trois de mortalité périnatale) (45).
- Le traitement par chélation doit être interrompu pendant la grossesse.
- La surveillance doit être régulière débutant de la période pré-conceptionnelle jusqu’à la fin de la grossesse (contrôles réguliers de la glycémie et du bilan lésionnel).
Conclusion
Dans la TM, la dysglycémie se produit progressivement et traverse un continuum d’une tolérance glycémique normale à une tolérance au glucose altérée, et éventuellement un vrai diabète sucré, parfois insulinodépendant. Ces anomalies glycémiques ont été documentées principalement dans la 2ème et la 3ème décade de la vie. Bien que le DS partage certaines caractéristiques avec à la fois le DT1 et le DT2, il semble être une entité distincte avec une physiopathologie propre à lui en passant par une période initiale d’insulinorésistance puis d’insulinopénie.
La détection des anomalies de l’homéostasie du glucose à un stade de prédiabète est impérative au plus tard à partir de l’âge de 10 ans. L’utilisation des régimes adéquats de chélation, la normalisation des niveaux de FS ainsi que la concentration de fer dans le foie et le dépistage des hépatites sont des mesures importantes de la prévention du diabète et peuvent empêcher, ou du moins retarder l’apparition de ces anomalies glycémiques.
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- Li CK. New trend in the epidemiology of thalassaemia. Best practice & research Clinical obstetrics & gynaecology. 2017; 39:16-26.
- Anderson LJ, Holden S, Davis B, Prescott E, Charrier CC, Bunce NH, et al. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. European heart journal. 2001;22(23):2171-9.
- Wood JC, Ghugre N. Magnetic resonance imaging assessment of excess iron in thalassemia, sickle cell disease and other iron overload diseases. Hemoglobin. 2008;32(1-2):85-96.
- Au WY, Lam WW, Chu W, Tam S, Wong WK, Liang R, et al. A T2* magnetic resonance imaging study of pancreatic iron overload in thalassemia major. Haematologica. 2008;93(1):116-9.
- De Sanctis V, Soliman AT, Elsedfy H, Skordis N, Kattamis C, Angastiniotis M, et al. Growth and endocrine disorders in thalassemia: The international network on endocrine complications in thalassemia (I-CET) position statement and guidelines. Indian journal of endocrinology and metabolism. 2013;17(1):8-18.
- De Sanctis V, Eleftheriou A, Malaventura C. Prevalence of endocrine complications and short stature in patients with thalassaemia major: a multicenter study by the Thalassaemia International Federation (TIF). Pediatric endocrinology reviews: PER. 2004;2 Suppl 2:249-55.
- Gamberini MR, Fortini M, Gilli G, Testa MR, De Sanctis V. Epidemiology and chelation therapy effects on glucose homeostasis in thalassaemic patients. Journal of pediatric endocrinology & metabolism: JPEM. 1998;11 Suppl 3:867-9.
- Gamberini MR, Fortini M, De Sanctis V, Gilli G, Testa MR. Diabetes mellitus and impaired glucose tolerance in thalassaemia major: incidence, prevalence, risk factors and survival in patients followed in the Ferrara Center. Pediatric endocrinology reviews: PER. 2004;2 Suppl 2:285-91.
- De Sanctis V, Soliman A, Yassin M. Iron overload and glucose metabolism in subjects with β-thalassaemia major: an overview. Current diabetes reviews. 2013;9(4):332-41.
- Luo Y, Bajoria R, Lai Y, Pan H, Li Q, Zhang Z, et al. Prevalence of abnormal glucose homeostasis in Chinese patients with non-transfusion-dependent thalassemia. Diabetes, metabolic syndrome and obesity: targets and therapy. 2019; 12:457-68.
- Toumba M, Sergis A, Kanaris C, Skordis N. Endocrine complications in patients with Thalassaemia Major. Pediatric endocrinology reviews: PER. 2007;5(2):642-8.
- Thuret I, Pondarré C, Loundou A, Steschenko D, Girot R, Bachir D, et al. Complications and treatment of patients with β-thalassemia in France: results of the National Registry. Haematologica
- 2010;95(5):724-9.
- De Sanctis V, Soliman AT, Elsedfy H, Yaarubi SA, Skordis N, Khater D, et al. The ICET-A Recommendations for the Diagnosis and Management of Disturbances of Glucose Homeostasis in Thalassemia Major Patients. Mediterranean journal of hematology and infectious diseases. 2016;8(1): e2016058.
- Mowla A, Karimi M, Afrasiabi A, De Sanctis V. Prevalence of diabetes mellitus and impaired glucose tolerance in beta-thalassemia patients with and without hepatitis C virus infection. Pediatric endocrinology reviews: PER. 2004;2 Suppl 2:282-4.
- He LN, Chen W, Yang Y, Xie YJ, Xiong ZY, Chen DY, et al. Elevated Prevalence of Abnormal Glucose Metabolism and Other Endocrine Disorders in Patients with β-Thalassemia Major: A Meta-Analysis. BioMed research international. 2019; 2019:6573497.
- De Sanctis V, Soliman AT, Elsedfy H, Pepe A, Kattamis C, El Kholy M, et al. Diabetes and Glucose Metabolism in Thalassemia Major: An Update. Expert review of hematology. 2016;9(4):401-8.
- Cavallo-Perin P, Pacini G, Cerutti F, Bessone A, Condo C, Sacchetti L, et al. Insulin resistance and hyperinsulinemia in homozygous beta-thalassemia. Metabolism: clinical and experimental. 1995;44(3):281-6.
- De Sanctis V, Skordis N, Soliman AT, Cohen A. Endocrine disease. Guidelines for the Management of Transfusion Dependent Thalassaemia (TDT)[Internet] 3rd edition: Thalassaemia International Federation; 2014.
- Barnard M, Tzoulis PJTR. Diabetes and thalassaemia. Thalassemia Reports. 2013.
- Sanctis VD, Soliman A, Yassin M. J Cdr. Iron overload and glucose metabolism in subjects with β-thalassaemia major: an overview. Current diabetes reviews. 2013;9(4):332-41.
- Fung EB, Gildengorin G, Talwar S, Hagar L, Lal AJN. Zinc status affects glucose homeostasis and insulin secretion in patients with thalassemia. Nutrients. 2015;7(6):4296-307.
- Matter RM, Elbarbary NS, Ismail EAR, Darwish YW, Nada AS, Banoub VPJN. Zinc supplementation improves glucose homeostasis in patients with β-thalassemia major complicated with diabetes mellitus: A randomized controlled trial. Nutrition. 2020; 73:110702.
- Monge L, Pinach S, Caramellino L, Bertero M, Dall’Omo A, Carta QJD, et al. The possible role of autoimmunity in the pathogenesis of diabetes in B-thalassemia major. Diabetes Metab 2001;27(2 Pt 1):149-54.
- Kattamis C, Ladis V, Tsoussis D, Kaloumenou I, Theodoridis C. Evolution of glucose intolerance and diabetes in transfused patients with thalassemia. Pediatric endocrinology reviews: PER. 2004;2 Suppl 2:267-71.
- Noetzli LJ, Papudesi J, Coates TD, Wood JCJB. Pancreatic iron loading predicts cardiac iron loading in thalassemia major. Blood. 2009;114(19):4021-6.
- Noetzli LJ, Mittelman SD, Watanabe RM, Coates TD, Wood JC. Pancreatic iron and glucose dysregulation in thalassemia major. American journal of hematology. 2012;87(2):155-60.
- El-Samahy MH, Tantawy AA, Adly AA, Abdelmaksoud AA, Ismail EA, Salah NY. Evaluation of continuous glucose monitoring system for detection of alterations in glucose homeostasis in pediatric patients with β-thalassemia major. Pediatric diabetes. 2019;20(1):65-72.
- Soliman AT, Yasin M, El-Awwa A, De Sanctis V. Detection of glycemic abnormalities in adolescents with beta thalassemia using continuous glucose monitoring and oral glucose tolerance in adolescents and young adults with β-thalassemia major: Pilot study. Indian journal of endocrinology and metabolism. 2013;17(3):490-5.
- Smaldone AJDs. Glycemic control and hemoglobinopathy: when A1C may not be reliable. Diabetes Spectrum Volume 2008;21(1):46-9.
- Choudhary A, Giardina P, Antal Z, Vogiatzi M. Unreliable oral glucose tolerance test and haemoglobin A1C in beta thalassaemia major–a case for continuous glucose monitoring? British journal of haematology. 2013;162(1):132-5.
- Debard A, Charmion S, Ben AS, Gaultier J, Cathébras PJLRdmi. Inappropriate low glycated hemoglobin and hemolysis. Rev Med Interne. 2009;30(6):525.
- Kattamis C, Delaporta P, Dracopoulou M, Paleologos G, Chrousos G, Papassotiriou I, et al. Credibility of HbA1c in diagnosis and management of disturbances of glucose and diabetes in transfused patients with thalassemia. Riv Ital Med Adolesc. 2014; 12:65-71.
- Singh Y, Garg MK, Tandon N, Marwaha RK. A study of insulin resistance by HOMA-IR and its cut-off value to identify metabolic syndrome in urban Indian adolescents. Journal of clinical research in pediatric endocrinology. 2013;5(4):245-51.
- Gomber S, Dabas A, Bagmar S, Madhu SVJJo PHO. Glucose homeostasis and effect of chelation on β cell function in children with β-thalassemia major. Pediatr Hematol Oncol. 2018;40(1):56-9.
- Berdoukas V, Farmaki K, Wood JC, Coates T. Iron chelation in thalassemia: time to reconsider our comfort zones. Expert review of hematology. 2011;4(1):17-26.
- Farmaki K, Angelopoulos N, Anagnostopoulos G, Gotsis E, Rombopoulos G, Tolis G. Effect of enhanced iron chelation therapy on glucose metabolism in patients with beta-thalassaemia major. British journal of haematology. 2006;134(4):438-44.
- Zonoozi S, Barnard M, Prescott E, Jones R, Shah FT, Tzoulis P. Effectiveness and Safety of Sitagliptin in Patients with Beta-thalassaemia Major and Diabetes Mellitus: A Case Series. Mediterranean journal of hematology and infectious diseases. 2017;9(1): e2017004.
- Bromage DI, Yellon DMJCD. The pleiotropic effects of metformin: time for prospective studies. Cardiovasc Diabetol. 2015;14(1):1-4.
- Dhouib N, Turki Z, Mellouli F, Ouederni M, Yahiaoui SJTm. Efficacy of metformin in the treatment of diabetes mellitus complicating thalassemia major. Tunis Med. 2010;88(2).
- Mangiagli A, Campisi S, De Sanctis V, Nicoletti MC, Cardinale G, Galati MC, et al. Effects of acarbose in patients with beta-thalassaemia major and abnormal glucose homeostasis. Pediatric endocrinology reviews: PER. 2004; 2:276.
- Konrad D, Daneman D, Kirby M, Wherrett D. Cardiac failure after initiation of insulin treatment in diabetic patients with beta-thalassemia major. The Journal of pediatrics. 2003;143(4):541-2.
- Loebstein R, Lehotay DC, Luo X, Bartfay W, Tyler B, Sher GD. Diabetic nephropathy in hypertransfused patients with beta-thalassemia. The role of oxidative stress. Diabetes care. 1998;21(8):1306-9.
- Pepe A, Meloni A, Rossi G, Caruso V, Cuccia L, Spasiano A, et al. Cardiac complications and diabetes in thalassaemia major: a large historical multicentre study. British journal of haematology. 2013;163(4):520-7.
- Incorvaia C, Parmeggiani F, Mingrone G, Sebastiani A, De Sanctis V. Prevalence of retinopathy in diabetic thalassaemic patients. Journal of pediatric endocrinology & metabolism: JPEM. 1998;11 Suppl 3:879-83.
- Yardumian A, Telfer P, Constantinou G, Darbyshire P, Darlison M, Kinsey S, et al. Standards for the Clinical Care of Children and Adults with Thalassaemia in the UK: United Kingdom Thalassaemia Society; 2005.
- Belhoul KM, Bakir ML, Saned MS, Kadhim AM, Musallam KM, Taher AT. Serum ferritin levels and endocrinopathy in medically treated patients with β thalassemia major. Annals of hematology. 2012;91(7):1107-14.
- Habeb AM, Al-Hawsawi ZM, Morsy MM, Al-Harbi AM, Osilan AS, Al-Magamsi MS, et al. Endocrinopathies in beta-thalassemia major. Prevalence, risk factors, and age at diagnosis in Northwest Saudi Arabia. Saudi medical journal. 2013;34(1):67-73.
- Jahantigh M, Naderi M, Dorgalaleh A, Tabibian SJZJoRiMS. Prevalence of diabetes and impaired glucose tolerance test in thalassemia major patients. Zahedan J Res Med Sci. 2013:29-31.
- Bejaoui M, Guirat N. Beta thalassemia major in a developing country: epidemiological, clinical and evolutionary aspects. Mediterranean journal of hematology and infectious diseases. 2013;5(1): e2013002.
- Bazi A, Sharifi-Rad J, Rostami D, Sargazi-Aval O, Safa A. Diabetes Mellitus in Thalassaemia Major Patients: A Report from the Southeast of Iran. Journal of clinical and diagnostic research: 2017;11(5): Bc01-bc4.