La néphrectomie partielle (NP) pour tumeur rénale permet de répondre à deux impératifs : oncologique, assurant une exérèse totale de la tumeur, fonctionnel en veillant à l’épargne néphronique. Son bénéfice est incontestable sur la fonction rénale, elle permet de diminuer le risque de développer une insuffisance rénale chronique post-opératoire. La néphrectomie partielle est une chirurgie techniquement complexe. Ce qui explique le risque élevé de complications péri-opératoires.
S. Yebdri, Service d’Urologie, CHU Mohamed Nedir, Tizi-Ouzou, Faculté de Médecine de Tizi-Ouzou, Algérie.
Date de soumission : 15 Novembre 2020.
Résumé : Introduction : La néphrectomie partielle (NP) pour tumeur rénale permet de répondre à deux impératifs : oncologique, assurant une exérèse totale de la tumeur, fonctionnel en veillant à l’épargne néphronique. Son bénéfice est incontestable sur la fonction rénale, elle permet de diminuer le risque de développer une insuffisance rénale chronique post-opératoire. La néphrectomie partielle est une chirurgie techniquement complexe. Ce qui explique le risque élevé de complications péri-opératoires. L’augmentation croissante de l’incidence de découverte de petites tumeurs du rein avec un faible potentiel d’agressivité doit faire proposer une technique sûre pour le patient avec le moins de séquelles possibles. Objectif : évaluer la morbidité péri-opératoire de la néphrectomie partielle dans le cancer du rein. Méthode : Nous avons réalisé une étude descriptive de la morbidité péri-opératoire de la néphrectomie partielle dans le traitement des tumeurs localisées du rein de moins de 7 cm avec comme critère principal d’évaluation, le taux de complications chirurgicales. ll s’agit d’une étude monocentrique portant sur 84 néphrectomies partielles consécutives. Les données concernant le patient (âge, IMC, index de comorbidité de Charlson), les modalités opératoires (temps de clampage), les caractéristiques tumorales (taille tumorale, RENAL score) ainsi que les suites opératoires (complications, transfusions sanguines, durée d’hospitalisation) ont été recueillies. Les groupes de patients sans et avec complications ont été comparés avec les tests du Chi 2 et de Student. Les facteurs prédictifs de complications ont été analysés par un modèle de régression logistique binaire. Résultat : L’âge moyen était de 55 ans (24-85). La taille tumorale moyenne était de 4,1 cm (1,9-7). Les durées opératoires moyennes, les pertes sanguines et le temps de clampage étaient respectivement de 148 min (70-280), 220 ml (50-1000) et de 18,6 mn (7-33). Vingt patients (25,3%) ont présenté une ou plusieurs complications. Dans 80% des cas il s’agissait de complication mineure (Clavien 1 et 2). Les complications chirurgicales correspondaient à une complication hémorragique, infectieuse ou une fistule urinaire dans 15,2%, 3,8% et 5,1% des cas respectivement. En analyse univariée les facteurs associés à une augmentation significative du risque de complications post opératoires graves, définies par un score de Clavien ≥ 3 étaient le score ECOG (p=0.003), l’index de Charlson (p=0.044), la durée opératoire (p=0.025), l’insuffisance rénale (p=0.017) et l’indication impérative (p=0.035). En analyse multivariée l’index de Charlson (p=0.018) et la durée opératoire (p=0.018) constituaient des facteurs prédictifs indépendants de complications post opératoires graves. L’âge et la complexité tumorale (RENAL score) n’avait pas d’impact sur la survenue de complications. Conclusion : La morbidité de la NP est essentiellement représentée par des complications mineures classées grade I et II de Clavien (80% des complications). Les principaux facteurs prédictifs de complications graves semblent essentiellement liés au patient (l’index des comorbidités de Charlson) et la durée opératoire. La néphrectomie partielle est une intervention sure et réglée à faible morbidité, elle a avantageusement remplacé la néphrectomie radicale pour les tumeurs rénales de moins de 7 cm.
Mots clés : Tumeurs du rein, néphrectomie partielle-mortalité, morbidité, fistule urinaire, hématome de la loge rénale.
Abstract: Introduction: Partial nephrectomy for renal tumour makes it possible to meet two requirements: oncological, ensuring total tumour resection, functional while ensuring nephron sparing. Its benefit is indisputable on renal function, it reduces the risk of developing postoperative chronic renal failure. Partial nephrectomy is a technically complex surgery. This explains the high risk of perioperative complications. The increasing incidence of discovery of small kidney tumours with low potential for aggression should lead to a safe technique for the patient with the least possible sequelae. Objective: evaluation of the perioperative morbidity of partial nephrectomy.
Method: We carried out a descriptive study of the perioperative morbidity of partial nephrectomy in the treatment of localized kidney tumours of less than 7 cm with as primary endpoint, the rate of surgical complications. This is a single-centre study involving 84 consecutive partial nephrectomies. Data concerning the patient (age, BMI, Charlson comorbidity index), the operating modalities (clamping time), the tumour characteristics (tumour size, RENAL score) as well as the postoperative consequences (complications, blood transfusions, duration of hospitalization) were collected. The groups of patients without and with complications were compared with Chi 2 and Student tests. The predictors of complications were analysed by a binary logistic regression model. Result: The mean age was 55 years (24-85). The mean tumour size was 4.1 cm (1.9-7). The mean operating times, blood loss and clamping time were 148 min (70-280), 220 ml (50-1000) and 18.6 min (7-33), respectively. Twenty patients (25.3%) presented one or more complications. In 80% of cases, it was a minor complication (Clavien 1 and 2). Surgical complications corresponded to a haemorrhagic, infectious or urinary fistula complication in 15.2%, 3.8% and 5.1% of cases respectively. In univariate analysis, the factors associated with a significant increase in the risk of serious postoperative complications, defined by a Clavien score ≥ 3 were the ECOG score (p=0.003), the Charlson index (p=0.044), the operating time (p=0.025), renal failure (p=0.017) and the imperative indication (p=0.035). In multivariate analysis, the Charlson index (p=0.018) and the operating time (p=0.018) were independent predictors of serious postoperative complications. Age and tumour complexity (RENAL score) had no impact on the occurrence of complications. Conclusion: The morbidity of PN is mainly represented by minor complications classified grade I and II of Clavien (80% of complications), The main predictive factors of serious complications seem essentially related to the patient (the index of Charlson comorbidities) and the operating time. Partial nephrectomy is a safe and regulated low morbidity intervention, it has advantageously replaced radical nephrectomy for kidney tumours smaller than 7 cm.Key words: Kidney tumours, partial nephrectomy, mortality, morbidity, urinary fistula, hematoma of the renal lodge.
Introduction
L’incidence du cancer du rein est en augmentation constante, les tumeurs localisées représentent le groupe qui a subi la plus forte augmentation [1], avec une proportion importante de tumeurs bénignes [2,3]. L’augmentation de l’espérance de vie, un diagnostic amélioré par une imagerie devenue plus performante et plus disponible, sont à l’origine de la découverte de cancers à des stades précoces, accessibles à un traitement conservateur. Le faible potentiel de croissance ainsi qu’un minime risque de progression des masses rénales de petite taille [4], une proportion plus importante de tumeurs bénignes 16,1 à 20% [5], l’augmentation de la mortalité globale liée à néphrectomie élargie sont à l’origine de l’essor de la néphrectomie partielle d’indication élective au cours de ces vingt dernières années [6]. La néphrectomie partielle est une technique sûre et reproductible, elle permet de répondre à deux impératifs, oncologique assurant une exérèse totale, de la tumeur mais également fonctionnel en veillant à l’épargne néphronique. Son bénéfice est incontestable sur la fonction rénale. La morbidité post-opératoire est un critère d’évaluation de la qualité globale du traitement [7]. Évaluer l’impact de la néphrectomie partielle dans les tumeurs du rein, nous amène forcement à nous poser les questions suivantes :
- Dans notre pratique, la néphrectomie partielle est-elle une intervention morbide ?
- Quel est le profil des patients pouvant bénéficier d’une néphrectomie partielle ?
- Y a-t-il une limite d’âge pour réaliser une chirurgie conservatrice ?
- L’extension de ses indications aux tumeurs du rein de plus de 4 cm engendre-t-il une augmentation significative de la morbidité ?
Le but de notre travail est de rapporter notre expérience de la NP en décrivant la technique, en rapportant les complications, avec une analyse comparative aux données de la littérature.
Technique
Toutes les interventions ont été réalisées sous anesthésie générale, en position latérale avec un billot sous le flanc. L’abord est une lombotomie sous la 11ème cote. Une néphrolyse complète est réalisée avant le clampage afin de bien exposer la zone tumorale et de définir la zone de résection. Dans notre série l’ischémie a été le plus souvent chaude par un clampage vasculaire artériel sélectif. La fermeture de la voie excrétrice est réalisée par un surjet ou des points en X. L’hémostase du lit de résection est réalisée par un surjet, les berges de section sont rapprochées par des points en U parfois associés à des pansements hémostatiques type SURGICEL. Un drain de Redon aspiratif est placé en regard de la zone de résection tumorale.
Résultats
Sur une période de 04 ans, 84 NP pour tumeurs rénales ont été réalisées chez 81 patients 33 hommes (40,7%) et 48 femmes (59,3%) avec un sex-ratio de 6,8 hommes pour 10 femmes. L’âge moyen au moment de l’acte chirurgical était de 55,1 ans ± 15,2 ans avec des extrêmes de 24 ans à 85 ans. La tranche d’âge de 60 à 70 ans était la plus touchée avec 30,9% des cas (n=25). Soixante-huit pour cent des patients (n=55) présentaient un ou plusieurs facteurs de risque de cancer du rein. L’obésité et HTA représentaient les facteurs de risque les plus fréquemment retrouvés respectivement dans 53% (n=43) et 36% (n=29) des cas. Dans 71,6% des cas (n=58) la tumeur du rein était découverte de façon fortuite. Seuls 28,4% (n=23) des tumeurs sont découvertes à l’occasion de manifestations urologiques se rapportant au haut appareil urinaire. Près de la moitié des patients (n=39) avaient une anomalie systémique modérée avec un score ASA égal à 2. Le score de Charlson moyen était de 4 avec des extrêmes de 2 à 11.
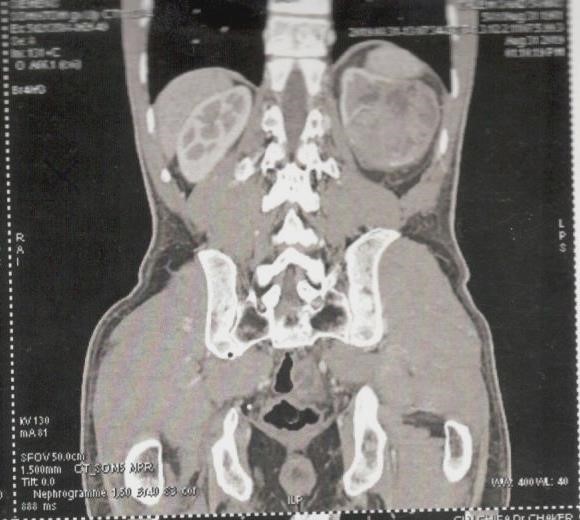
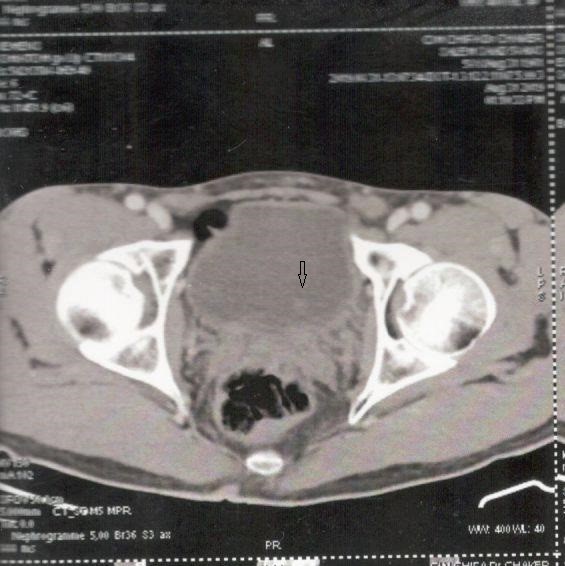
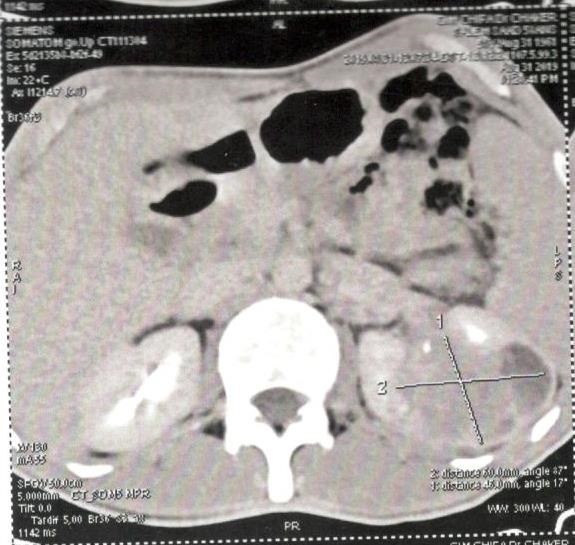
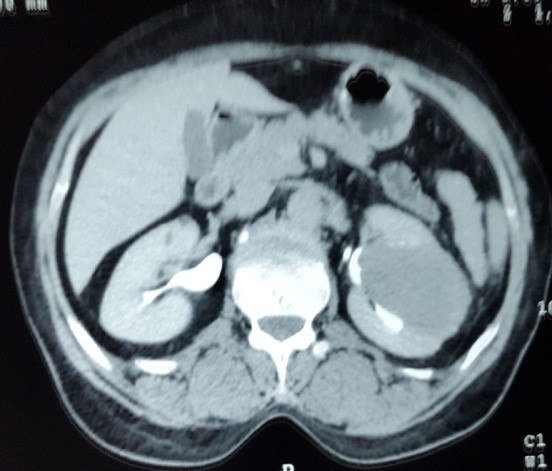
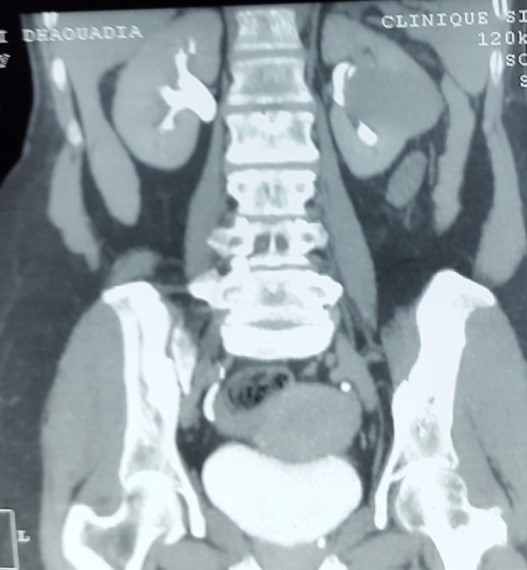
Le diagnostic et le bilan d’extension étaient faits par une TDM TAP, l’IRM était nécessaire en cas d’insuffisance rénale. La taille tumorale moyenne était de 4,1 cm (1,9-7). Dans 78,60% des cas (n=66) la tumeur était de nature solide. Parmi les 18 tumeurs kystiques de notre série la moitié était de type III, l’autre de type IV selon la classification de Bosniak. Sur l’imagerie préopératoire, 56% des tumeurs (n=47) étaient classées T1aN0M0 et 44% (n=37) T1bN0M0.
La majorité de nos patients avaient bénéficié d’une néphrectomie partielle pour une indication de principe, nous avons distingué 2 sous-types d’indications impératives : rein unique avec un antécédent de néphrectomie totale pour tumeur rénale (n=2), le délai moyen entre la néphrectomie partielle et la néphrectomie totale était de 27 mois et l’insuffisance rénale préopératoire avec une clairance à la créatinine inférieure à 60 ml/min (n=8). Les tumeurs du rein étaient classées en fonction de leur degré de complexité selon la classification de Kutikov : RENAL Score faible 34,5% (n=29), RENAL Score intermédiaire 45,2% (n=38), RENAL Score élevé : 20,20% (n=17).
L’abord chirurgical était une lombotomie chez tous nos patients. Le clampage était artériel dans 70,20% des cas (n=59), pédiculaire en masse dans 21,4% (n=18). L’exérèse tumorale a été réalisée sans clampage vasculaire (zéro ischémie) dans 8,3% des cas (n=7). La durée moyenne du clampage vasculaire en cas d’ischémie chaude était de 17,8 minutes. Un refroidissement rénal par réfrigération de contact avec de la glace pilée stérile a été réalisé dans 7,8% des cas (n=6). La durée moyenne du clampage vasculaire en cas d’ischémie froide était de 28,8 minutes sans différence statistiquement significative en cas d’ischémie chaude (p=0.000). La visualisation de l’ouverture des voies excrétrices par l’opérateur a été notée dans 71,4% des cas (n=60) ce qui avait permis la réalisation d’une suture élective. Le temps opératoire moyen était de 148 minutes avec des extrêmes de 70 à 280 minutes.
Deux techniques chirurgicales étaient principalement réalisées tumorectomie ou résection cunéiforme dans 56% des cas (n=47), néphrectomie polaire dans 44% des cas (n=37), du fait de la taille tumorale supérieure à 4 cm ou d’une localisation inaccessible à une résection cunéiforme. Les pertes sanguines et le temps de clampage étaient respectivement de 220 ml (50-1000) et de 18,6 min. Dans 71,4% des cas (n=60) les pertes sanguines étaient estimées à moins de 200 ml.
Nous avons eu recours à une transfusion sanguine per-opératoire dans 14,8% des cas (n=12). Le temps opératoire moyen était de 148 min (70-280). Le séjour moyen de nos patients était de 6,2 jours (3-23 jours) en fonction de l’évolution et de la survenue ou non de complications précoces. Les tumeurs malignes représentaient 63,1% de l’ensemble des tumeurs de notre série (n=53), les tumeurs bénignes 27,4% (n=23). Les autres variétés histologiques représentaient 9,5% de l’ensemble des tumeurs (n=8), il s’agissait de kystes type III et type IV de Bosniak kystes radiologiquement suspects de malignité, l’examen anatomopathologique ne retrouvait pas de lésion tumorale. Le taux de marge chirurgicale positive est de 6,6% (n=5).
Dans notre série nous avons enregistré deux décès (n=2) en période post-opératoire précoce. 74,7% des patients (n=59) n’avaient pas présenté de complications post-opératoires. Le taux de morbidité globale était de 25,3% (n=20). 22,8% des patients de notre série (n=18) avaient présenté des complications chirurgicales, 6,30% (n=5) des complications médicales. Les complications chirurgicales étaient les plus fréquentes, essentiellement représentées par l’hématome de la loge rénale : 15,20% des cas (n=12). Seuls 3,8% des patients ont reçu une transfusion de culots globulaires en période post-opératoire (n=3). Aucun patient n’avait nécessité une reprise chirurgicale pour hémostase.
La fistule urinaire, complication chirurgicale spécifique à la néphrectomie partielle, a été observée dans 5,10% des cas (n=4). La durée moyenne d’évolution de la fistule urinaire était de 20,7 jours avec des extrêmes de 15 jours à 24 jours. Nous avons eu recours à une montée de sonde urétérale type JJ dans 3 cas. Dans un cas, nous n’avons pas procédé à une montée de sonde type JJ, la fistule urinaire s’est tarie spontanément et progressivement après 15 jours d’évolution.
Les complications spécifiques à la néphrectomie partielle représentées par l’hématome de la loge rénale (n=12), et les fistules urinaires (n=4) représentaient 20,30% (n=16) des complications post-opératoires observées. Les complications infectieuses (abcès de paroi et de la loge de néphrectomie) étaient retrouvées dans 3,8% des cas (n=3). Les complications non spécifiques à la chirurgie conservatrice du rein représentaient 10,1% (n=8) des complications post opératoires, dominées par les infections de paroi et les complications médicales. Selon la classification de Dindo Clavien 5,1% des patients (n=4) ont présenté des complications majeures, classées Clavien ≥ 3. Dix-neuf pour cent des patients (n=15) d ont présenté des complications mineurs, classées Clavien 1 et 2.
En analyse univariée, les facteurs associés à une augmentation significative du risque de complications post-opératoires graves, définis par un score de Clavien ≥ 3 étaient le score ECOG moyen (p=0.003), l’index des comorbidités de Charlson (p=0.044), la durée opératoire (p=0.025), l’insuffisance rénale avec un débit de filtration glomérulaire estimé par la clairance au MDRD < 60ml/min (p=0.017), l’indication impérative (p=0.035).
En analyse multivariée, l’index des comorbidités de Charlson (p=0.018) et la durée opératoire (p=0.018) constituaient des facteurs prédictifs indépendants de complications post-opératoires graves.
Discussion
Depuis sa description par Vermooten, la chirurgie conservatrice du rein est longtemps restée de diffusion confidentielle. La crainte des complications a constitué un frein au développement de la néphrectomie partielle [8]. La plupart des auteurs notaient la difficulté de cette intervention, notamment pour le risque important de fistule urinaire et d’hémorragie per- et post-opératoire. La néphrectomie partielle était réservée seulement aux cas où la néphrectomie élargie rendrait le malade anéphrique. La diminution progressive de la morbidité, les excellents résultats sur les plans carcinologique et fonctionnel de la chirurgie conservatrice impérative sont à l’origine de l’essor de la néphrectomie partielle en pathologie tumorale rénale ces deux dernières décennies.
L’augmentation de l’incidence des petites tumeurs du rein avec un faible potentiel d’agressivité a rendu nécessaire le développement d’une technique chirurgicale sûre pour le patient avec le moins de séquelles possibles [9].
Cependant la chirurgie conservatrice est pourvoyeuse de complications spécifiques non observées en cas de néphrectomie radicale [10]. Notre série composée de 33 hommes et 48 femmes, se caractérise par une prédominance féminine : 59% de femmes versus 41% d’hommes, avec un sexe ratio de 0,68 soit 6,8 hommes pour 10 femmes ; contrairement à ce qui est décrit dans la littérature ou la prédominance masculine est retrouvée par plusieurs auteurs. Plus de 2/3 des lésions rénales (71% des lésions) ont été découvertes fortuitement sur une imagerie abdominale pour une symptomatologie non spécifique.
Ces examens réalisés le plus souvent à l’occasion d’un bilan d’une maladie générale tels le diabète et l’hypertension artérielle, parfois pour de problèmes gynécologiques ou de douleurs abdominales liées à une colopathie fonctionnelle. La lecture de nos résultats permet de confirmer la tendance actuelle du mode de découverte fortuite des lésions rénales. Dans notre série, les indications électives concernaient 88% des patients et aucune tumeur ne dépassait 7 cm. Actuellement, la lombotomie reste la voie d’abord la plus habituelle pour la NP qu’elle soit élective ou de nécessité [11,12]. C’est la voie d’abord utilisée dans notre série. Plus rarement, pour des tumeurs antérieures, la voie d’abord peut être abdominale, sous-costale [4].
Quelle que soit la voie d’abord, la chirurgie conservatrice doit respecter les grands principes de la chirurgie oncologique et certains éléments spécifiques. La connaissance précise de la topographie de la lésion et ses rapports avec la voie excrétrice et le système vasculaire, est fondamentale pour permettre un geste dans des conditions optimales et ne pas compromettre les résultats carcinologiques [4].
La néphrectomie laparoscopique apporte les avantages de cet abord avec une diminution du saignement per-opératoire et une durée d’hospitalisation plus courte, avec un contrôle oncologique similaire. L’abord laparoscopique pur est une alternative à la chirurgie ouverte qui peut être réalisée par des équipes entraînées et chez des patients sélectionnés. Le taux de complications péri-opératoires et la durée d’ischémie sont supérieurs en chirurgie laparoscopique par rapport à la chirurgie ouverte. Ces différences tendent à s’atténuer avec l’expérience de l’opérateur et l’utilisation de la technique de déclampage précoce [13].
La néphrectomie partielle robotisée est une technique émergente qui associe les avantages de la chirurgie laparoscopique à ceux de la robotique : vision et dextérité augmentées [14]. Les modalités opératoires sont les mêmes qu’en chirurgie laparoscopique, avec des durées de clampage généralement inférieures et des volumes de saignements en faveur de la néphrectomie partielle coelioscopique robot-assistée par rapport à la laparoscopie seule en raison de l’aisance chirurgicale, vision 3D, mobilité des instruments. Les résultats sur le plan carcinologique sont similaires aux autres techniques chirurgicales sans augmentation du taux de complications post-opératoires [15].
L’assistance robotique permet une diminution de la courbe d’apprentissage et des durées d’ischémie chaudes [15]. Dans les centres équipés, à haut débit de néphrectomie partielle, avec des opérateurs expérimentés, l’abord coelioscopique robot-assisté est devenu le standard. Dans la NP, un clampage artériel isolé est requis, facilitant la dissection et l’hémostase du parenchyme rénal sain qui est effectuée avec des fils résorbables. Rarement, pour des exérèses plus complexes, un clampage total du pédicule artériel et veineux est nécessaire. Le clampage vasculaire expose au risque de blessure du pédicule et surtout à l’ischémie chaude, responsable de l’altération de la fonction rénale, mais réversible si elle ne dépasse pas 25 à 30 minutes. Pour diminuer cet effet, l’hypothermie est utilisée, permettant une ischémie froide jusqu’à 60 minutes. Le clampage vasculaire peut être pédiculaire intéressant l’artère et la veine rénale en masse ou uniquement artériel. Pour la plupart des auteurs, le clampage de l’artère rénale permet de réaliser une tumorectomie dans les meilleures conditions [15].
Le rationnel d’un clampage vasculaire exclusivement artériel est la préservation d’un flux veineux rétrograde permettant un apport en oxygène. Ainsi pour ses défenseurs, le clampage artériel permet une oxygénation rétrograde et facilite l’identification des veines au niveau des tranches de section parenchymateuse [16]. Gong et ses collaborateurs ont comparé le clampage de l’artère seule au clampage de l’artère et de la veine chez 25 et 53 patients, respectivement. La clairance de la créatinine post-opératoire a été supérieure en cas de clampage de l’artère seule. Les pertes sanguines et les taux de marges chirurgicales positives étaient équivalents.
Cependant, en cas d’insuffisance rénale chronique préexistante, les différences de clairances de la créatinine observées dans les deux groupes n’étaient pas significatives. L’auteur note qu’il est probable que l’apport en oxygène par le flux veineux rétrograde n’était pas suffisant pour protéger de l’ischémie les reins préalablement pathologiques [17].
Le clampage intermittent de l’artère rénale est à proscrire, car il entraine des phénomènes d’ischémie/re-perfusion qui s’accompagnent de plus de dommage rénal que le clampage continu temporaire [18,19]. La durée d’ischémie chaude maximale recommandée est de 25 minutes au delà la majoration du risque de lésion due à l’ischémie chaude nécessite le recours à des techniques d’ischémie froide [120]. Une hypothermie sera réalisée par un refroidissement de surface par de la glace pillée qui sera disposée en péri-rénale permettant une ischémie froide jusqu’à 60 minutes. Dans notre série, le clampage était artériel dans 70,20% des cas (n=59), artério-veineux en masse dans 21,4% (n=18). L’exérèse tumorale était faite sans clampage (zéro ischémie) dans 8,3% des cas (n=7). En cas de clampage vasculaire (n=77), le temps de clampage moyen était de 18,6 minutes.
La mortalité opératoire est rare, dans notre série nous n’avons enregistré aucun décès per-opératoire. Nous avons eu recours à la transfusion de culots globulaires en per-opératoire chez 12 patients soit dans 14,8% des cas. Ce taux est proche du taux de transfusion de 10% rapporté par Bernhard [21]. Les pertes sanguines moyennes dans notre série sont de 220 ml, inférieures à celles retrouvées par et Thompson [22].
La mortalité post-opératoire précoce – définie comme étant la mortalité qui survient dans les 30 jours qui suivent l’intervention chirurgicale et/ou durant l’hospitalisation – est rare, elle est le plus souvent d’origine médicale, secondaire à une comorbidité importante. Elle est de l’ordre de 0 à 4,8% [23]. Dans notre série, sur les 81 patients opérés, nous avons enregistré deux décès en période post-opératoire précoce, soit dans 2,50% des cas, avec un âge moyen de 79 ans. Ces décès sont liés à des complications générales d’origine cardiovasculaire. Les deux patientes décédées, présentaient des comorbidités importantes sans altération des capacités physiques associées. L’indication de la néphrectomie partielle était, dans les deux cas, impérative. Dans le groupe des indications électives, nous n’avons enregistré aucun décès.
Le taux de décès observé dans notre série est comparable à celui de la littérature [23] et confirme que les complications graves affectent surtout les patients relevant d’une indication de nécessité. La morbidité précoce de la néphrectomie partielle est définie par l’apparition de complications post-opératoires non mortelles dans les 30 jours ayant suivi la néphrectomie partielle et/ou durant l’hospitalisation. Les complications globales représentent l’ensemble des complications post-opératoires précoces médicales et chirurgicales. Dans notre série, le pourcentage global de complications post-opératoires précoces est de 25,3%, soit un patient sur quatre. Ce taux assez élevé s’explique par la prise en compte de tous les évènements intercurrents, même mineurs.
Ce taux est comparable aux données de la littérature : 4,1 à 38,6% [24,25,26]. Les complications chirurgicales sont répertoriées et gradées selon la classification de Clavien [27]. Les complications mineures sont celles nécessitant une simple observation ou un traitement médical (Grade I et II).
Les complications majeures sont celles nécessitant un traitement chirurgical, endoscopique ou radiologique (complications de Grade III), ou celles engageant le pronostic vital et nécessitant des soins intensifs (complications de Grade IV). Les complications chirurgicales sont retrouvées dans 22,8% des cas, ce taux de complications est toutefois acceptable, comme en témoigne l’absence de complications chirurgicales graves mettant en jeu le pronostic vital. Notre taux de complications chirurgicales globales semble par contre important car nous avons colligé dans notre série toutes les complications chirurgicales même mineures. En ne prenant en considération que les complications chirurgicales majeures définies comme étant de grade ≥ III selon la classification de Dindo-Clavien, ce taux descend à 3,8% des cas.
Il s’agit de trois cas de fistules urinaires ayant nécessité une prise en charge chirurgicale post-opératoire par montée de sonde urétérale type JJ. Ainsi, la majorité des complications dans notre série sont mineures. Ce taux est comparable à ceux publiés dans les séries les plus récentes (moins de 5%).
Dans une revue de la littérature concernant 1.129 patients, Uzzo et collaborateurs [15] ont rapporté un taux moyen de complications chirurgicales majeures de 13,7%. Bernhard [28] dans une étude multicentrique incluant 741 NP a noté un taux de complications chirurgicales majeures de 14,7%. Dans notre série, la reprise chirurgicale post-opératoire précoce a été nécessaire chez 03 patients (3,8%), il s’agit dans ces trois cas, de montée de sonde urétérale type JJ. Ce taux de reprise chirurgicale est comparable à celui décrit dans la littérature (0 à 5,4%) [29].
Ce faible taux de ré-intervention représente pour nous un indicateur fiable d’une technique opératoire maîtrisée et sûre. La définition de la fistule urinaire varie selon les auteurs. Certains la définissent comme une fuite d’urine de plus de 50 ml au-delà du septième jour opératoire [30], et d’autres par un taux élevé de créatinine qui persiste dans le système de drainage [24,31]. Elle provient habituellement d’une fuite sur la suture de la voie excrétrice, ou quelques fois d’un fond caliciel exclu sur la tranche de NP [18]. La fistule urinaire est une complication fréquente avec des taux de 1,4 à 17,4% dans les plus grandes séries [31,32]. Le taux de fistules que nous avons observé (5,1%) est comparable à celui de la littérature (1,4-17,4%).
Dans notre série, les complications hémorragiques sont les complications chirurgicales post-opératoires les plus fréquentes. L’hématome de la loge rénale est la complication la plus retrouvée avec 15,20% des cas (n=12). Seul 3,8% de nos patients (n=3) ont nécessité une transfusion de culots globulaire en période post-opératoire. Ce taux est comparable aux données de la littérature qui est de 0% à 7,9% [22]. Nous n’avons enregistré aucune reprise chirurgicale pour hémostase. Le taux d’infection de paroi que nous avons observé est de 2,5%, comparable aux données de la littérature (0 à 2,7%) [25,32].
2,5% des patients ont présenté une atrophie rénale globale dans les suites opératoires. Nous rejoignons ainsi les conclusions de Zhang [35] qui montre que dans un contexte d’une ischémie chaude limitée, une atrophie importante parenchymateuse n’est que rarement observée.
Quel est le profil des patients pouvant bénéficier d’une néphrectomie partielle ? Les différentes études épidémiologiques tendent à montrer que la néphrectomie partielle est surtout utilisée chez les sujets jeunes. Pourtant deux études Lowrance [36] et Staehler [37] ont montré l’absence de différence significative en termes de morbidité, de temps opératoire ou de perte sanguine chez les sujets âgés.
Dans notre série 10% de l’effectif a plus de 70 ans. Le taux de complications globales observé était de 5,1%, nettement inférieur au taux de complications observé dans la cohorte de patients âgés de moins de 70 ans (20,3%), sans différence statistiquement significative entre les deux groupes (p=0.107). Nos résultats rejoignent ainsi ceux de la littérature.
Ainsi au-delà des considérations techniques de faisabilité, l’âge chronologique au moment du diagnostic ne doit pas être pris seul comme facteur décisionnel pour la réalisation de la néphrectomie partielle, mais corrélé aux scores évaluant l’état général du patient tels que le score ASA, le score ECOG performans status et les comorbidités du patients évalués par l’index de Charlson. En effet les complications graves observées dans notre cohorte sont surtout l’apanage de sujets âgés, mais il s’agit de patients qui ont de lourdes comorbidités associées, chez lesquels l’indication de la néphrectomie partielle était, dans la majorité des cas, impérative.
L’âge est probablement un facteur confondant qui n’est pas ressorti lors de l’analyse multivariée recherchant les facteurs prédictifs de complications graves. Ces données doivent nous inciter à une stricte sélection de patients candidats à une chirurgie conservatrice en intégrant l’état général du patient évalué par les scores que nous avons cité comme éléments déterminants à la réalisation d’une chirurgie conservatrice techniquement faisable.
Conclusion
La chirurgie partielle a connu ces vingt dernières années une large diffusion. Cette technique ne concerne plus les seuls patients pour lesquels elle constitue une indication impérative mais une majorité d’indications par choix délibéré.
Elle constitue aujourd’hui la solution la plus adéquate d’un point de vue carcinologique et fonctionnel pour le traitement des tumeurs localisées du rein. D’une part, elle permet un contrôle carcinologique équivalent à celui de la néphrectomie élargie, quelle que soit la taille tumorale, d’autre part, elle apporte une meilleure préservation de la fonction rénale, ce qui permet de diminuer le risque d’évènements cardiovasculaires liés à l’insuffisance rénale, et donc d’améliorer la survie globale.
Notre étude nous a permis de mettre en évidence une morbidité faible dans le respect des bonnes indications, avec un nombre de complications modéré, le plus souvent de faible gravité, une morbidité comparable quel que soit le siège et la taille de la tumeur.
Il n’existe pas de limite d’âge pour proposer une chirurgie partielle. L’ensemble de ces éléments permet de justifier la diffusion de cette technique dans la pratique chirurgicale ainsi que son statut de traitement de référence des tumeurs localisées du rein. Sa diffusion pourrait certainement permettre d’augmenter la proportion de néphrectomies partielles dans notre pratique courante.
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts.
Iconographie : Collection personnelle de l’auteur.
Illustration des différents temps opératoires
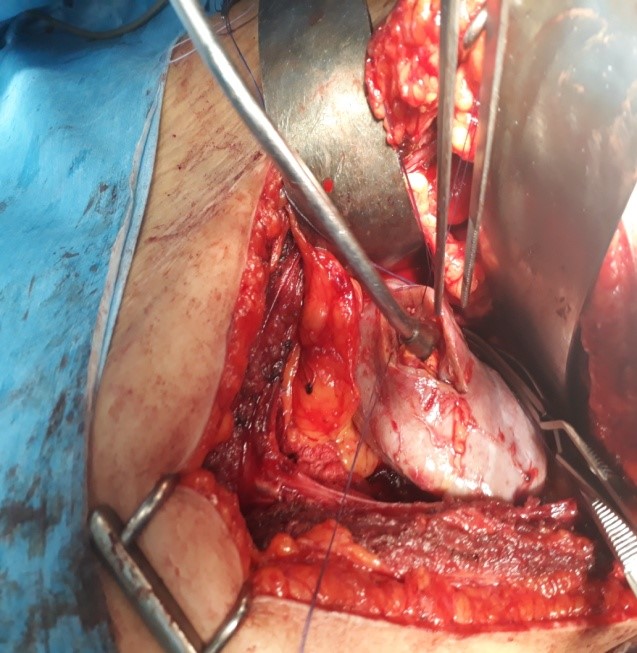
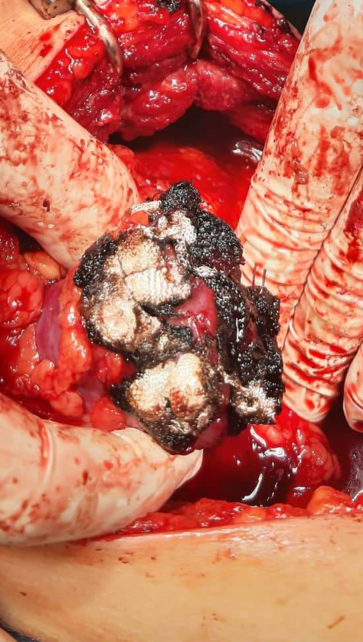
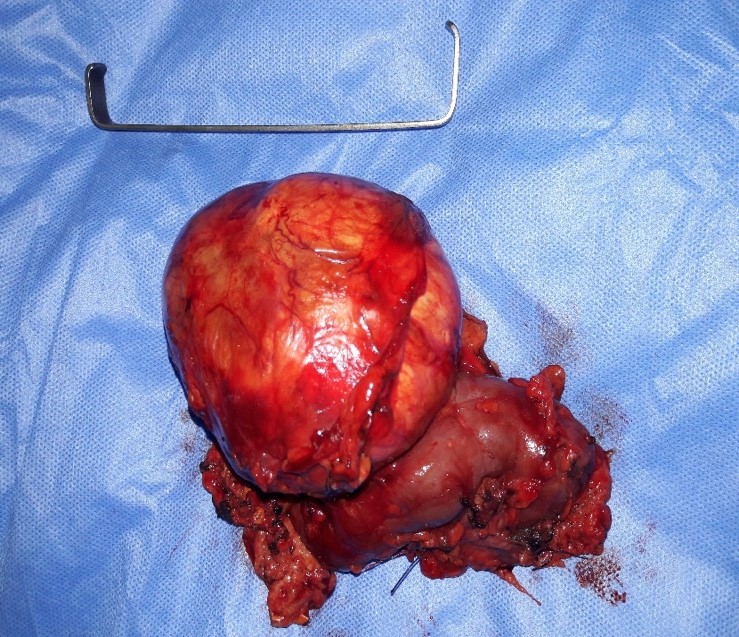
FIG 1 : Incision du parenchyme rénale sain pour découvrir la tumeur qui est entièrement endophytique. Noter le clamp vasculaire sur l’artère rénale.
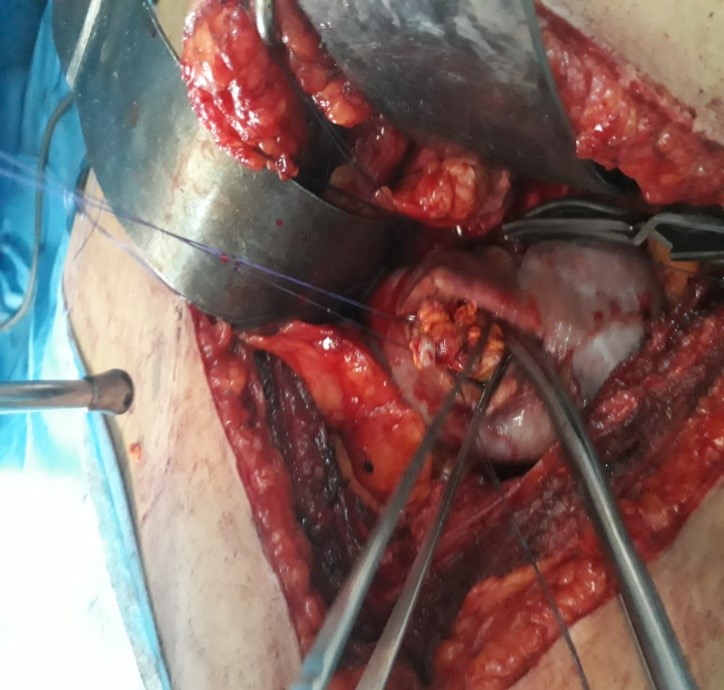
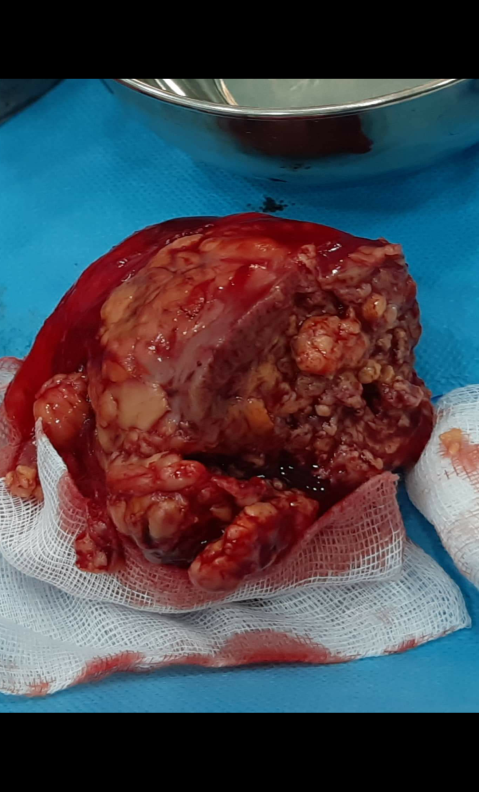
FIG 2 : Libération en monobloc de la tumeur d’aspect jaune chamois.
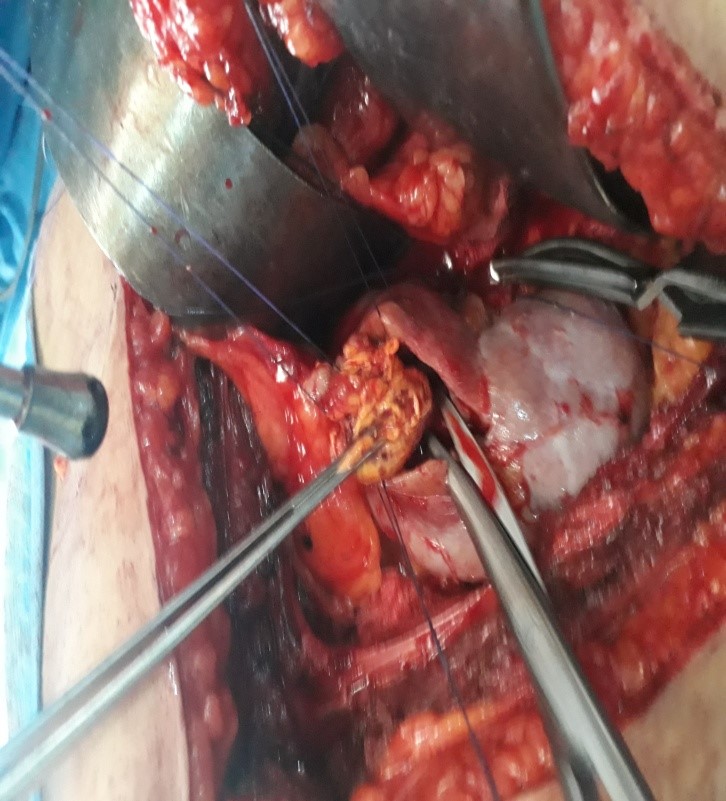
FIG 3 : Le plan profond de la tumeur est libéré.
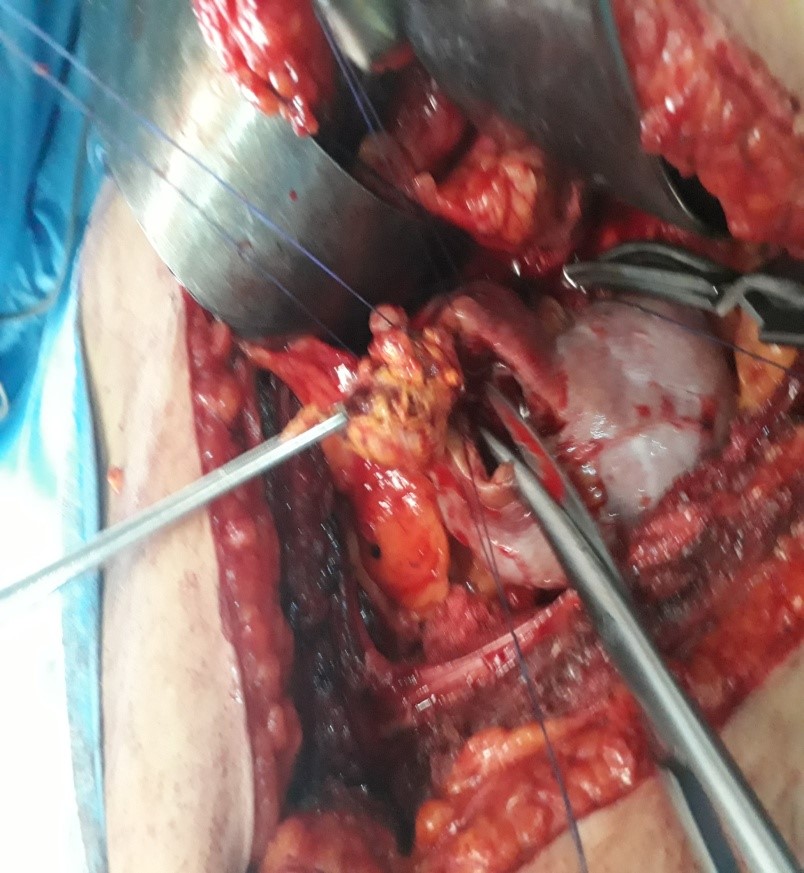
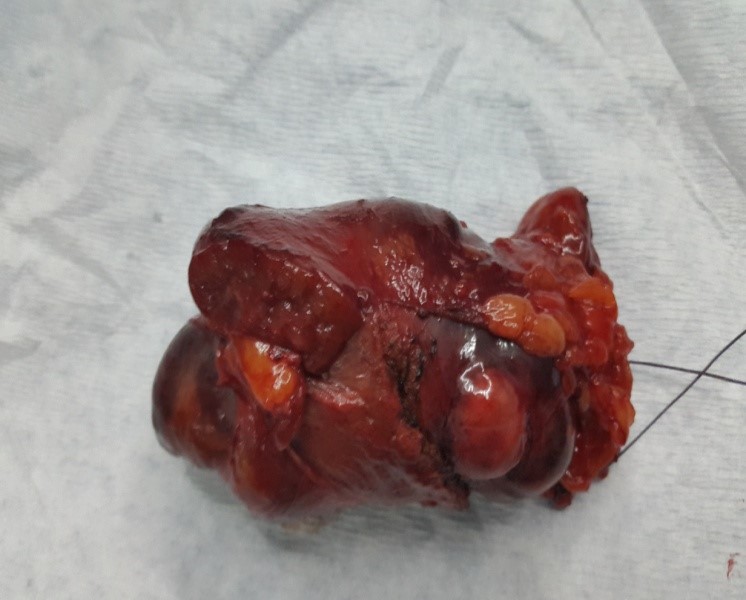
FIG 4 : Exérèse en monobloc de la tumeur
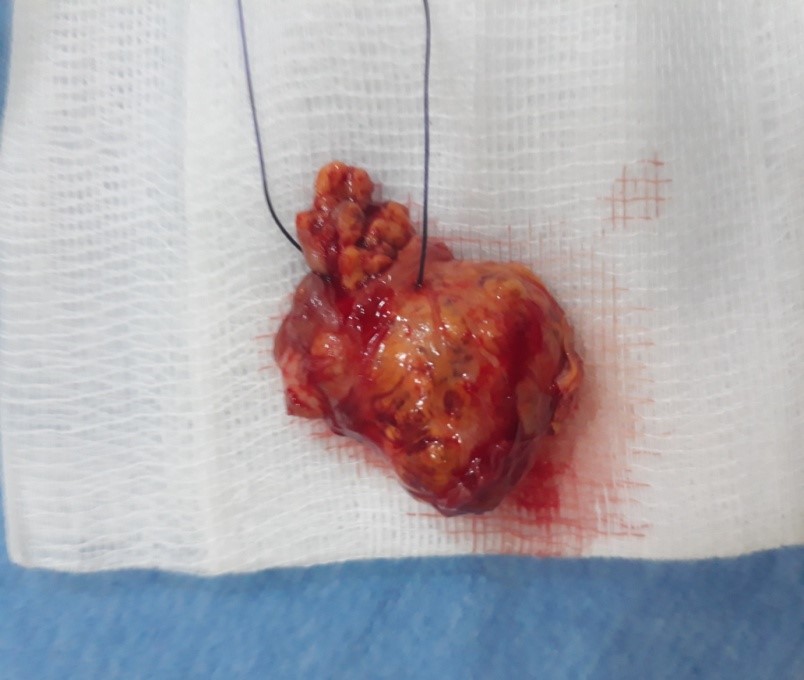
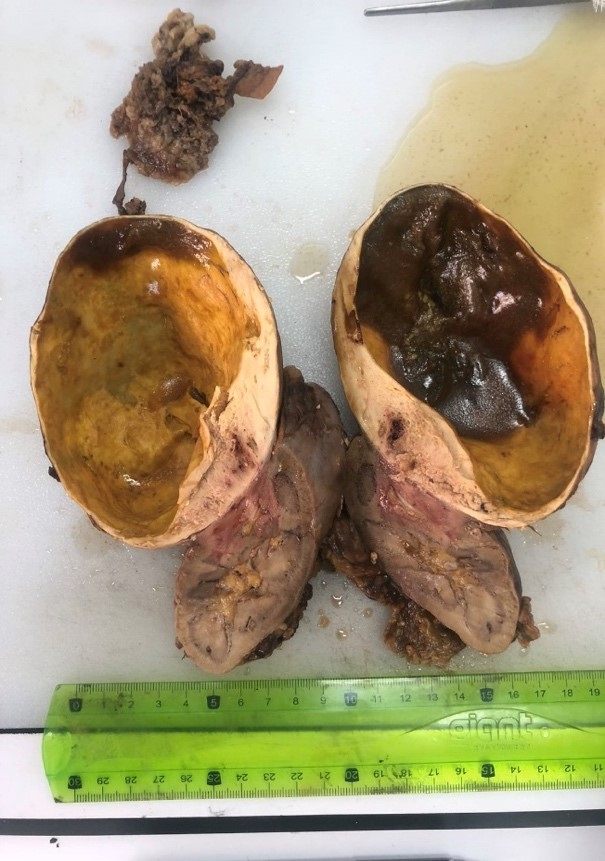
FIG 5 : Pièce de néphrectomie partielle.
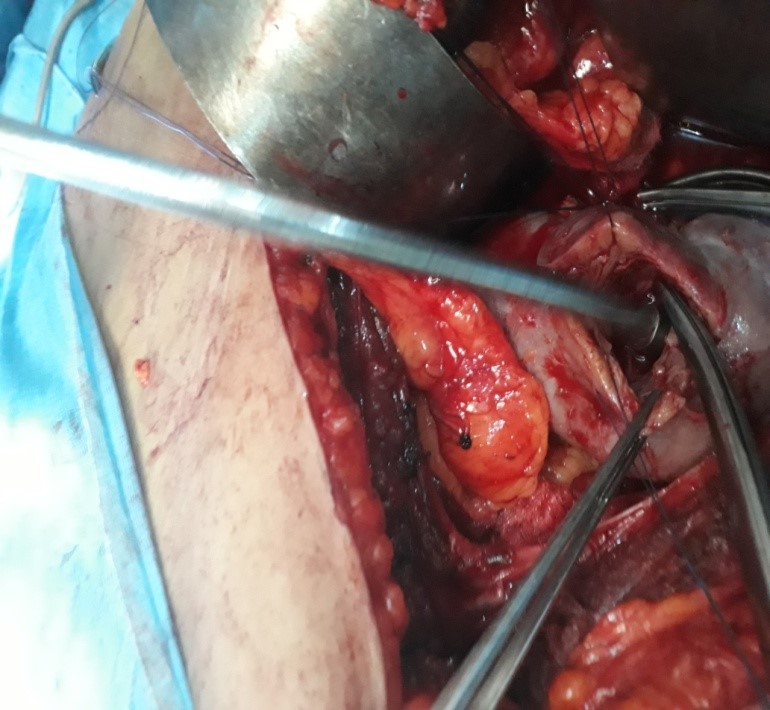
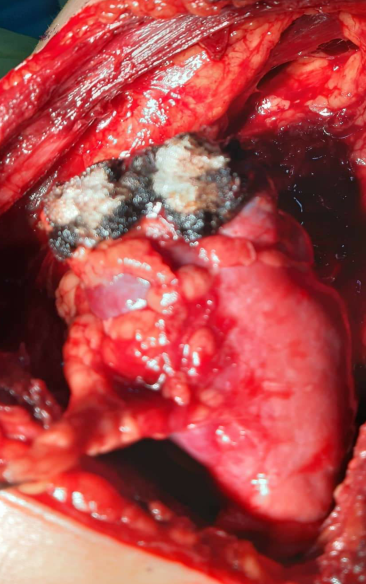
FIG 6 : Le lit de la tumeur.
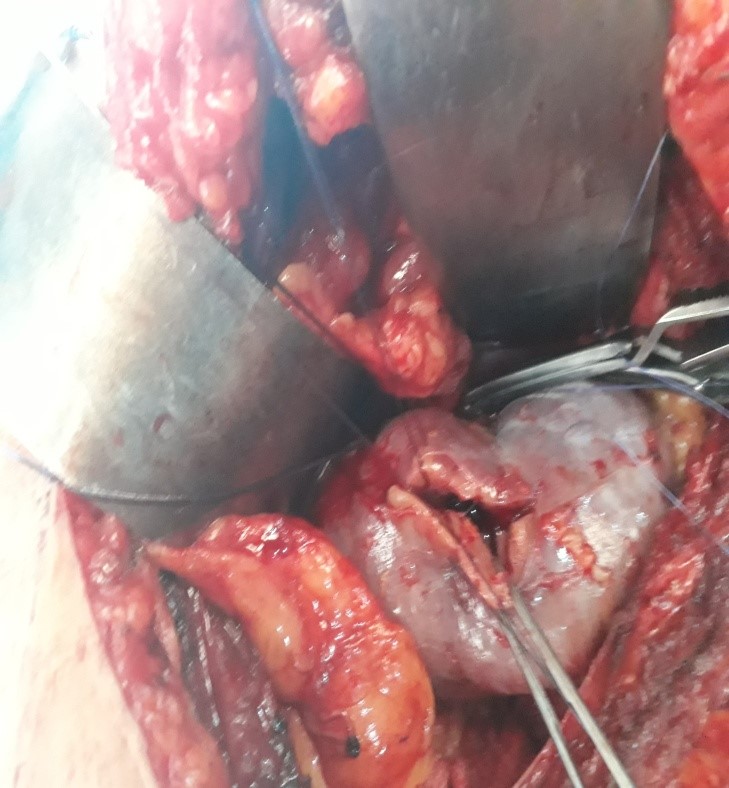
FIG 7 : Suture du plan profond
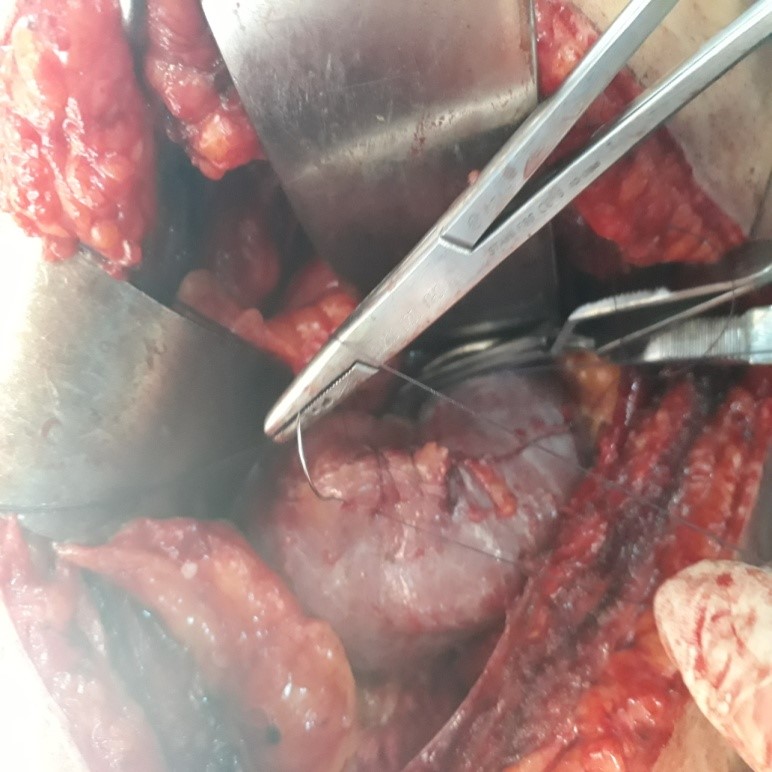
FIG 8 : Suture du plan superficiel.
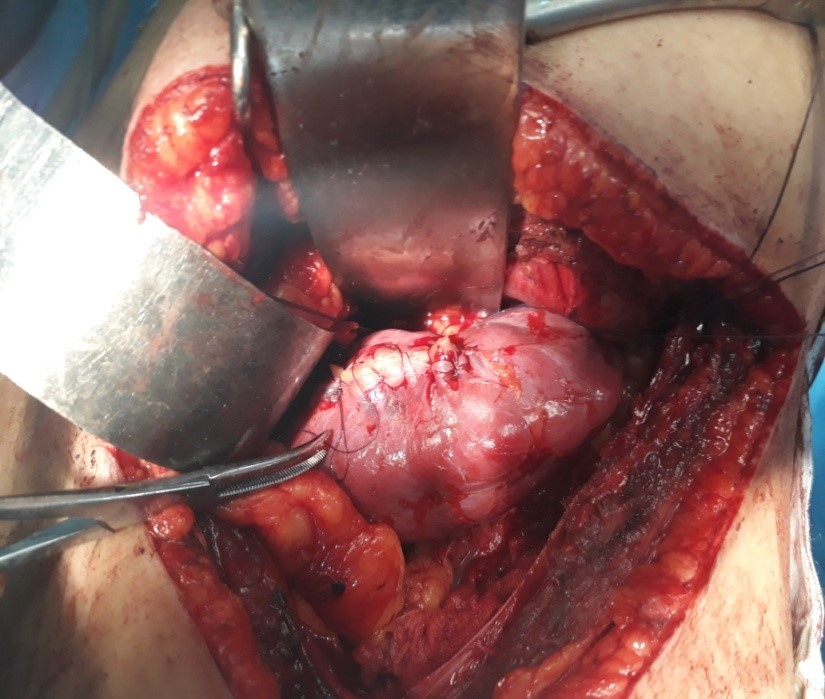
FIG 9 : Déclampage vasculaire et fin de procédure.
Références
- Hollingsworth JM. Rising incidence of small renal masses: a need to reassess treatment effect. J. Natl. Cancer Inst 2006 sept; 98(18):1331-1334.
- Frank I. Solid renal tumors: an analysis of pathological features related to tumor size. J Urol., 2003, 2217-20.
- Thompson R. Tumor size is associated with malignant potential in renal cell carcinoma cases. The Journal of urology.2009; 181:2033-6.
- Kouba E. Watchful waiting for solid renal masses: insight into the natural history and results of delayed intervention. The Journal of urology. 2007;177(2):466-70.
- Kutikov l. Incidence of benign pathologic findings at partial nephrectomy for solitary renal mass presumed to be renal cell carcinoma on preoperative imaging. Urology. 2006;68(4):737-40.
- Fergany AF. Long-term results of nephron sparing surgery for localized renal cell carcinoma: 10-year follow-up. J Urol. 2000;163:442—5.
- Hung A.J. Trifecta in partial nephrectomy. J Urol 2013;189:36-42.
- Places respectives de la nephrectomie elargie et de la nephrectomie partielle dans le traitement des tumeurs du rein de stade T1.Thèse présentée et soutenue devant la faculté de médecine PARIS DESCARTES septembre 2011.
- Lindblad P. Epidemiology of renal cell carcinoma. Scand J Surg 93: 88-96,2004.
- Breda A. Complications of Laparoscopic Surgery for Renal Masses: Prevention, Management, and Comparison with the Open Experience. Eur Urol. 2009 Apr;55(4):836–50.
- Carini M. Conservative surgery for renal cell carcinoma. Eur Urol. 1981;7(1):19-24.
- Kutikov A. Incidence of benign pathologic findings at partial nephrectomy for solitary renal mass presumed to be renal cell carcinoma on preoperative imaging. Urology. 2006;68(4):737-40.
- Ljungberg Bl. Renal Cell Carcinoma Guideline. Eur Urol., 2007 ; 51 : 1502-1510.
- Sand M. Complications de la néphrectomie partielle robotisée Techniques chirurgicales – Urologie41-035-E.
- Uzzo RG. Nephron sparing surgery for renal tumors: indications, techniques and outcomes. J Urol 2001;166:6-18.
- Colombel M. Chirurgie conservatrice et hypothermie rénale : bases physiologiques et technique opératoire. EMC (Elsevier Masson SAS, Paris), Techniques chirurgicales – Urologie, 41-035-A, 2006.
- Campbell SC. Campbell-Walsh Urology. Philadelphia: Saunders Elsevier; 2007. p. 1720-31
- Bernhard J.-C. Chirurgie conservatrice à ciel ouvert pour tumeur du rein EMC (Elsevier Masson SAS, Paris), Techniques chirurgicales – Urologie,41-035, 2009.
- Novick AC. Partial nephrectomy for renal cell carcinoma. Urol Clin N Amer 1987;14:419–33.
- Funahashi Y. Ischemic renal damage after nephronsparing surgery in patients with normal contralateral kidney. Eur Urol., 2009 ; 55 : 209-215.
- Bernhard J-C. Predictive factors for ipsilateral recurrence after nephron-sparing surgery in renal cell carcinoma. Eur. Urol. 2010 juin;57(6):1080-1086.
- Thompson RH. Complications of contemporary open nephron sparing surgery: a single institution experience. J Urol 2005;174:855—8.
- Arroua F.. Chirurgie conservatrice du rein pour cancer : indications et résultats. A propos d’une revue de 40 patients. Progrès en urologie 2008 Sep; 18(8): 499-506.
- Lerner SE. Disease outcome in patients with low stage renal cell carcinoma treated with nephron sparing or radical surgery. J Urol 1996; 155:1868-73.
- Shekarriz B. Comparison of costs and complications of radical and partial nephrectomy for treatment of localized renal cell carcinoma. Urology 2002 févr; 59(2):211-215.
- Schiff JD. Laparoscopic vs open partial nephrectomy in consecutive patients: the Cornell experience. BJU Int. 2005 oct;96(6):811-814.
- Dindo D. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg 2004;240:205—13.
- Bernhard J-C. Quelle pratique de la néphréctomie partielle en France ? Progrès en urologie (2008)18, 428-434.
- Bastide C. Chirurgie conservatrice du rein pour cancer : indications et résultats. A propos d’une revue de 40 patients. Progrès en urologie 2008 Sep; 18(8): 499-506.
- Campbell SC. Complications of nephron sparing surgery for renal tumors. J Urol 1994; 151:1177–80.
- Belldegrun A. Efficacy of nephron-sparing surgery for renal cell carcinoma: analysis based on the new 1997 tumor-node-metastasis staging system. J Clin Oncol 1999; 17:2868-75.
- Campbell SC. Complications of nephron sparing surgery for renal tumors. J. Urol. 1994 mai; 151(5):1177-1180.
- Steinbach F.Conservative surgery of renal cell tumors in 140 patients: 21 years of experience. J.Urol. 1992 juill; 148(1):24-29.
- Duque JL. Partial nephrectomy: alternative treatment for selected patients with renal cell carcinoma. Urology 1998;52:584.
- Huang W.C. Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. Lancet Oncol 2006: 735-40.
- Lowrance WT. Complications after radical and partial nephrectomy as a function of age. The Journal of Urology 2010;183:1725-30.
Télécharger le PDF de cet article
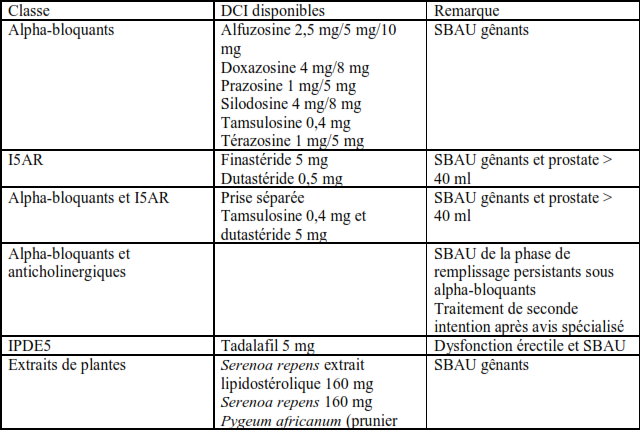
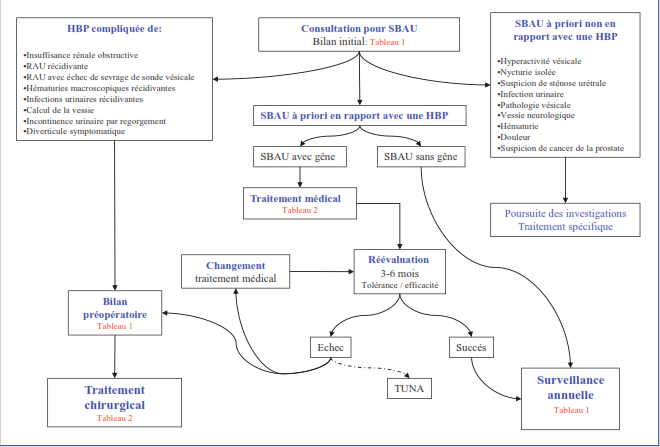
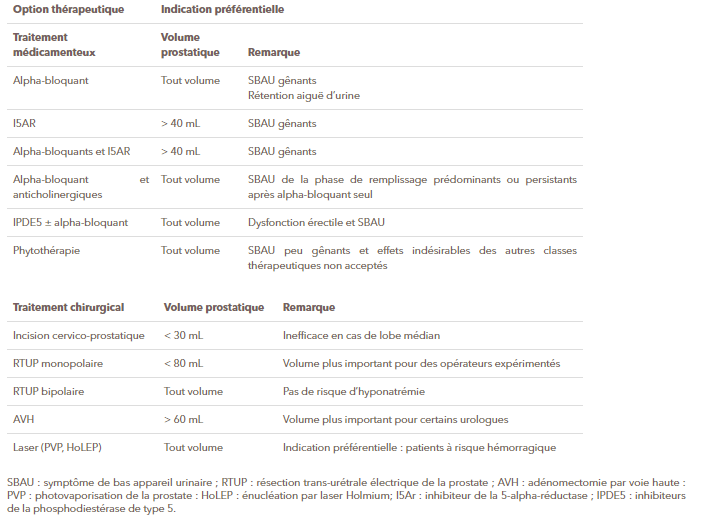
 Tableau 2 : Examens recommandés en cas de symptômes du bas appareil urinaire de la phase de remplissage prédominants ou de nycturie isolée (4).
Tableau 2 : Examens recommandés en cas de symptômes du bas appareil urinaire de la phase de remplissage prédominants ou de nycturie isolée (4).