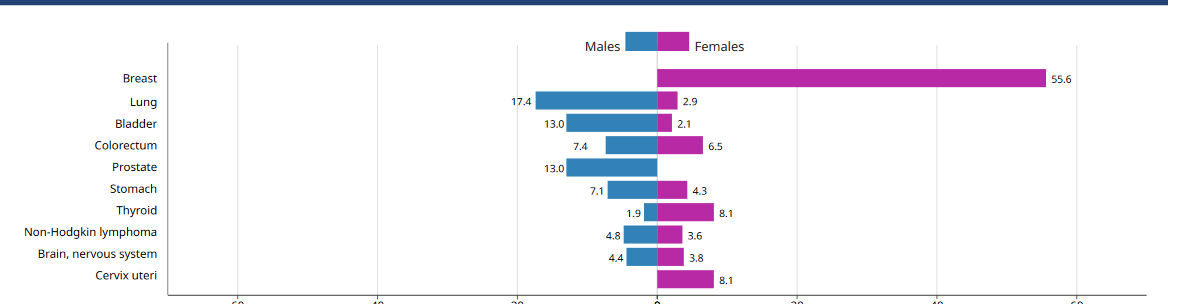
Le cancer pulmonaire est la première cause de mortalité par cancer dans le monde. Les carcinomes bronchiques non à petites cellules représentent 85% des cancers pulmonaires.
F. Oudjida, A. Slimani, Service d’Anatomie Pathologique, CHU Issaad Hassani, Béni Messous, Faculté de Médecine d’Alger
Date de soumission : 11 Octobre 2020.
Résumé : Le cancer pulmonaire est la première cause de mortalité par cancer dans le monde. Les carcinomes bronchiques non à petites cellules représentent 85% des cancers pulmonaires. La classification de l’OMS 2015 des tumeurs du poumon reconnaît trois principaux groupes : les adénocarcinomes, les carcinomes épidermoïdes et les tumeurs neuro-endocrines. Les progrès réalisés dans la compréhension des mécanismes moléculaires dans la carcinogénèse de ces tumeurs ont abouti au développement des thérapies ciblées et l’amélioration de la survie des patients. La réalisation des tests moléculaires prédictifs de thérapie ciblée dans l’adénocarcinome fait partie actuellement de l’arbre décisionnel du thérapeute.
Mots clés : adénocarcinome, driver mutations, EGFR, ALK, immunohistochimie.
Abstract: Lung cancer is the leading cause of cancer death worldwide. Non-small cell lung carcinomas account for 85% of lung cancers. The 2015 WHO classification of lung tumours recognize three main groups: adenocarcinomas, squamous cell carcinomas and neuroendocrine tumours. Advances in understanding the molecular mechanisms involved in the carcinogenesis of these tumours have led to the development of targeted therapies and improved patient survival. Performing predictive molecular tests for targeted therapy in adenocarcinoma is currently part of the therapist’s decision tree.
Key words: adenocarcinoma, driver mutations, EGFR, ALK, immunohistochemistry.
Introduction
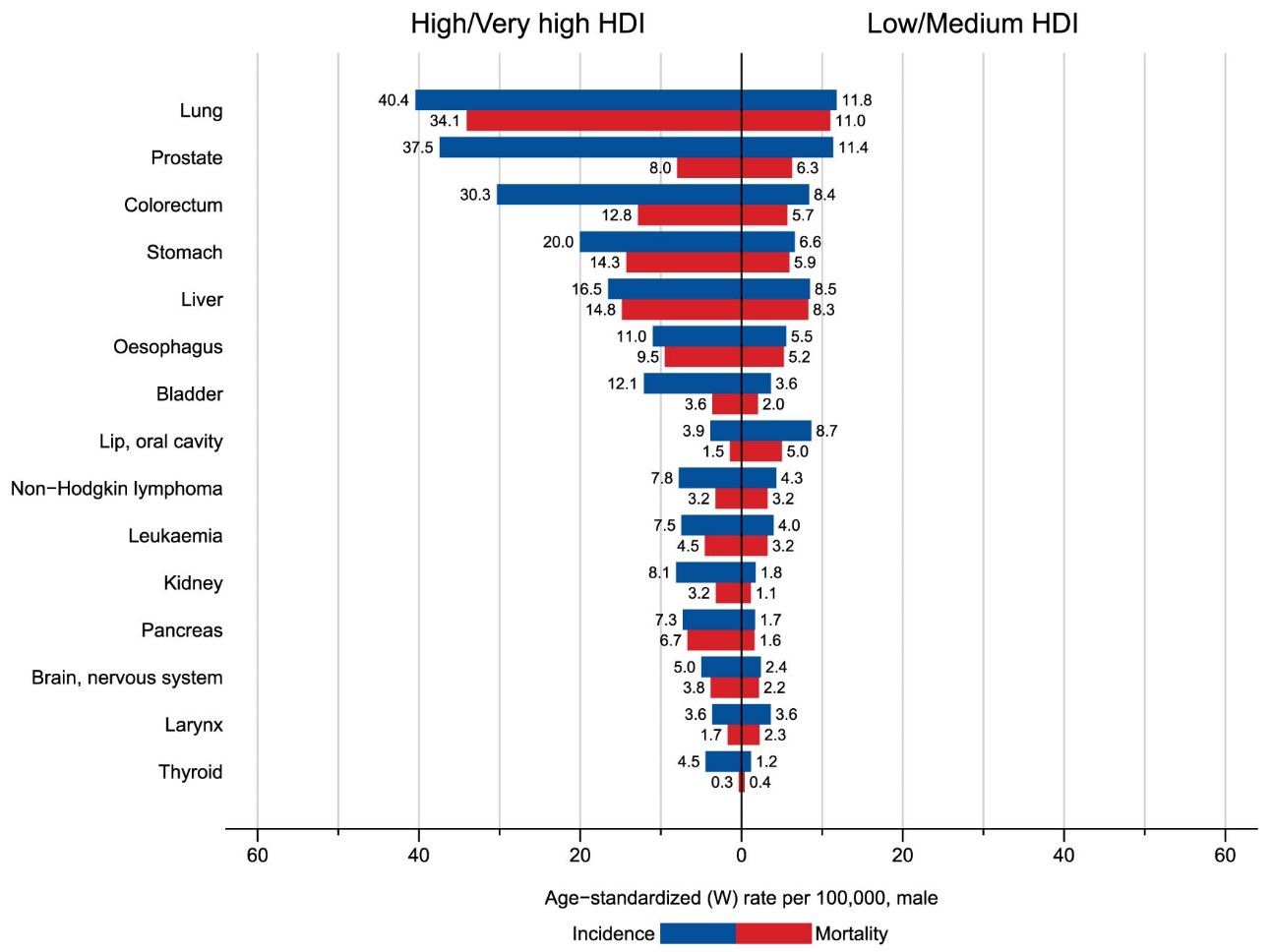
Le cancer du poumon représente la première cause de mortalité par cancer chez l’homme dans le monde [1].
Il est classé en deux principaux groupes histologiques : le carcinome pulmonaire à petites cellules (CPPC) qui représente 15% et le carcinome pulmonaire non à petites cellules (CPNPC) qui représente 85% de tous les cancers du poumon [2].
Les CPNPC sont généralement subdivisés en adénocarcinome, carcinome épidermoïde et carcinome à grandes cellules. L’adénocarcinome est actuellement le type histologique le plus fréquent parmi les non à petites cellules.
La classification des tumeurs du poumon de l’OMS 2015 a permis d’établir des définitions précises de certaines entités en s’aidant de l’aspect radiologique, de l’aspect histologique et immunohistochimique. Elle a également intégré les données moléculaires.
L’adénocarcinome abrite des anomalies moléculaires à type de de mutations ponctuelles, délétions et translocations qui sont détectées sur prélèvement fixé au formol et inclus en paraffine (FFPE : Fixed formalin embedded in paraffin).
Les mutations, ou les translocations intéressant ces gènes sont actuellement les cibles d’activité de thérapeutiques dites ciblées et sont recherchées par différentes techniques.
Les mutations décrites en cancérologie pulmonaire sont des mutations somatiques. C’est-à-dire acquises par les cellules cancéreuses au cours du développement tumoral. Elles sont en général mutuellement exclusives.
Le rôle essentiel de la médecine personnalisée est d’adapter le traitement individuel du cancer du poumon basé sur une classification histologique précise et des informations sur les biomarqueurs. Donc, la caractérisation du type histologique du cancer du poumon joue un rôle important dans l’approche multidisciplinaire dans le diagnostic et la prise en charge du cancer du poumon.
Reconnaissant la diversité biologique du cancer du poumon, une approche complète et précise de la classification de ces tumeurs a été développée, ce qui est important pour le traitement et pour le pronostic.
Adénocarcinome
L’adénocarcinome est le type le plus fréquent du cancer du poumon, représentant plus de 40% des cancers du poumon, 60% des CPNPC et plus de 70% des cas réséqués chirurgicalement [2,3,4].
L’incidence de l’adénocarcinome a augmenté régulièrement au cours des dernières décennies. L’adénocarcinome pulmonaire est le plus souvent de localisation périphérique avec fibrose centrale et rétraction pleurale.
La classification OMS de 2015 divise les adénocarcinomes en adénocarcinome in situ (AIS, lésion pré-invasive), adénocarcinome à invasion (AIM),ou adénocarcinome invasif, en se basant sur le degré de l’envahissement (Tableau 1). En effet Le taux de survie sans maladie de l’AIS et de l’AIM lorsque la tumeur est complètement réséquée est 100% [5].
Tableau 1. Classification OMS 2015 des tumeurs du poumon [2]
Les lésions pré invasives ou à invasion minime
- Adénocarcinome in situ
L’adénocarcinome in situ (AIS) représente des tumeurs de taille relativement petite (≤3 cm) d’architecture lépidique avec des cellules néoplasiques se développant le long de structures alvéolaires préexistantes, sans signe d’invasion stromale, vasculaire ou pleurale, et sans diffusion aérogène [6] (voir Fig. 1 A et B). Il est diagnostiqué uniquement sur pièce opératoire.
La croissance lépidique est généralement en corrélation avec l’opacité du verre dépoli sur les radiographies.
- Adénocarcinome à invasion minime AIM
L’AIM correspond à une lésion localisée unique dont la taille tumorale est ≤ 3cm. C’est une prolifération tumorale d’architecture lépidique avec foyer(s) invasion(s) d’invasion ≤ 5mm (micro-invasion) sans embole vasculaire ni infiltration pleurale, et il n’existe pas de progression aérienne.
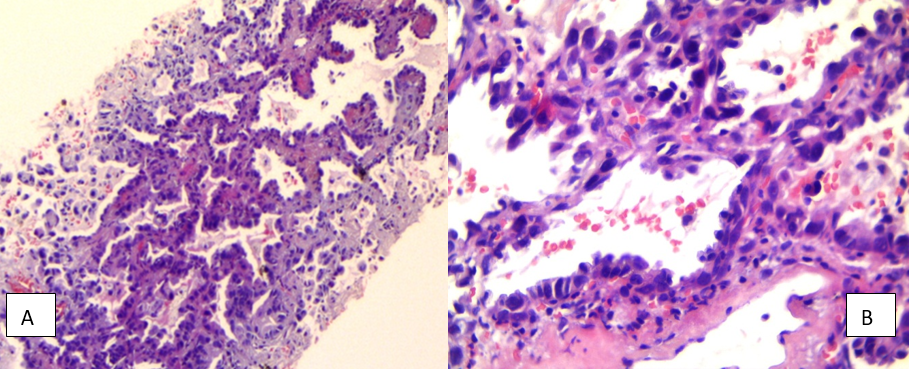
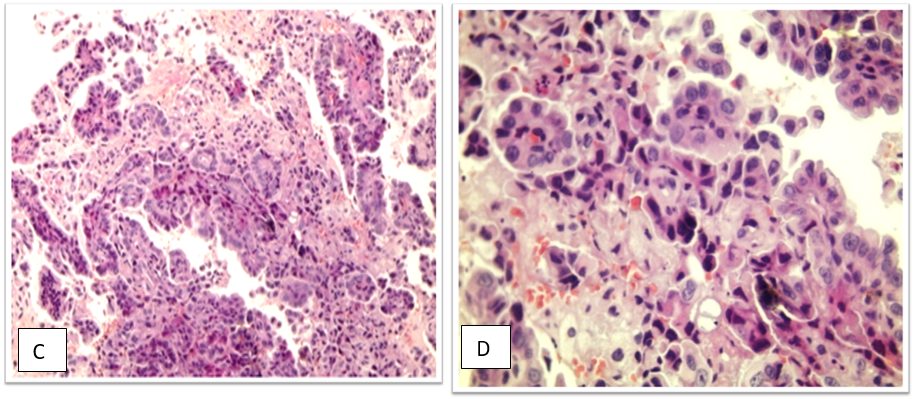
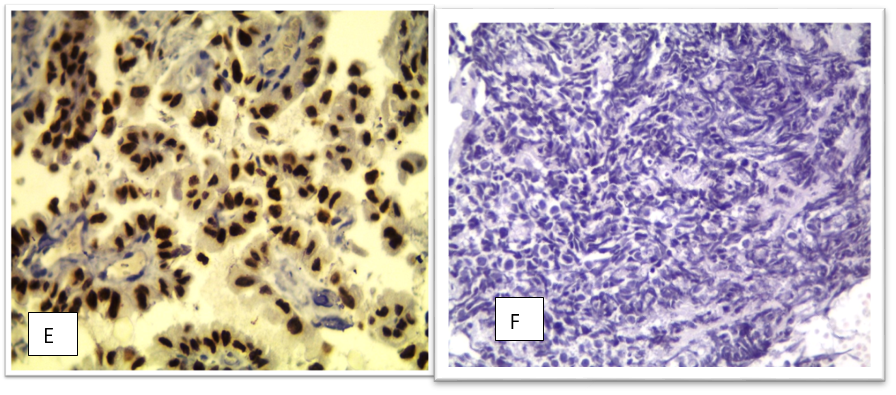 Figure 1. Images histologiques des adénocarcinomes et CPPC. A & B : Adénocarcinome de morphologie lépidique. (A : HE×20, B : HE×40). C : ADK papillaire (HE×20), D : ADK micro papillaire (HE×40), E : ADK papillaire TTF1 positif (IHC×40), F : CPPC (HE×40).
Figure 1. Images histologiques des adénocarcinomes et CPPC. A & B : Adénocarcinome de morphologie lépidique. (A : HE×20, B : HE×40). C : ADK papillaire (HE×20), D : ADK micro papillaire (HE×40), E : ADK papillaire TTF1 positif (IHC×40), F : CPPC (HE×40).
Adénocarcinomes invasifs
La plupart des adénocarcinomes invasifs sont composés de sous-types morphologiques mixtes ; ceux-ci sont classés en fonction des aspects architecturaux prédominants. Chaque tumeur est classée selon le pattern architectural prédominant, y compris lépidique, acineux, papillaire, micropapillaire et solide.
Cette classification basée sur l’architecture a une signification pronostique. En effet les adénocarcinomes à prédominance lépidique ont un pronostic plus favorable que les adénocarcinomes à prédominance acineuse et papillaire qui sont à pronostic intermédiaire, alors que les adénocarcinomes à prédominance solide et micro-papillaire ont un mauvais pronostic [7,8,9].
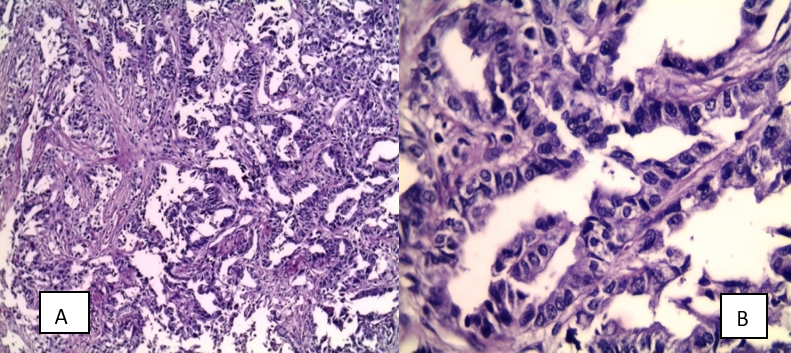
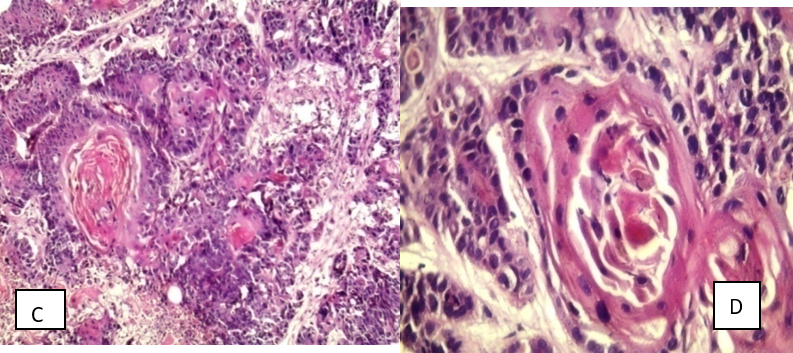
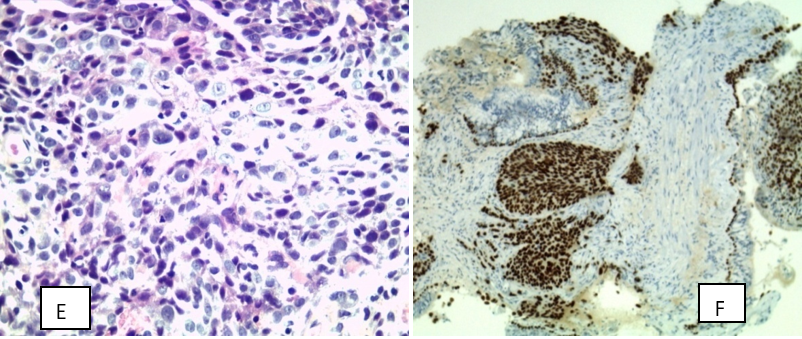
Figure 2 : Images histologiques des adénocarcinomes et carcinome épidermoïde, A & B : ADK acinaire (A : HE×20, B : HE×40), C & D : Carcinome épidermoïde kératinisant, E : Carcinome épidermoïde non kératinisant (HE×40), F : Carcinome épidermoïde bronchique non kératinisant : Expression nucléaire à la P63).
- Adénocarcinome lépidique. Une croissance lépidique est fréquemment observée dans les adénocarcinomes pulmonaires. Le modèle de croissance lépidique désigne des cellules tumorales se propageant le long des structures alvéolaires préexistantes.
- Adénocarcinome acineux. L’adénocarcinome acineux est un type d’adénocarcinome avec des cellules tumorales organisées dans la structure glandulaire classique sur un stroma fibro-élastique (Fig. 2 A,B).
- Adénocarcinome papillaire. Les cellules tumorales forment une architecture papillaire avec des cellules tumorales tapissant la surface d’axes fibro-vasculaires ramifiés (Fig. 1 C).
- Adénocarcinome micro-papillaire. Les cellules tumorales forment des touffes cellulaires individuelles sans axe fibro-vasculaire (Fig. 1 D,E).
- Adénocarcinome Solide. Les cellules tumorales n’ont pas de disposition particulière, elles s’agencent en massifs.
Rares Variantes de l’Adénocarcinome Invasif. Les variantes rares de l’adénocarcinome invasif comprennent l’adénocarcinome mucineux invasif, l’adénocarcinome colloïde et fœtal et l’adénocarcinome entérique.
Les carcinomes épidermoïdes
Ils représentent environ 30% des cancers bronchopulmonaires en Europe et aux États-Unis et leur fréquence décroit régulièrement au profit des adénocarcinomes.
Il s’agit de prolifération épithéliale maligne dont les cellules élaborent de la kératine et/ou sont séparées par des ponts d’union intercellulaires (Fig. 2 C,D,E,F). La forme basaloïde est reconnue par la présence de cellules de petite taille formant des lobules délimités par une assise palissadique et ébauchant des plages de différenciation épidermoïde.
Les carcinomes à grandes cellules
Ils représentent moins de 3% des cancers du poumon [10,11].
Il s’agit de CPNPC peu différenciés ne présentant pas les critères de différenciation des carcinomes épidermoïdes ou glandulaires. Les cellules néoplasiques sont dépourvues de muco-sécrétion et n’expriment pas les marqueurs malpighiens ou glandulaires en IHC (Immunophénotype nul). Il s’agit donc d’un diagnostic d’exclusion. Le diagnostic est porté uniquement sur pièce opératoire.
Tumeurs neuroendocrines : TNE
Les TNE en tant que groupe sont des tumeurs du poumon relativement fréquentes, représentant environ 20% à 25% des cancers du poumon [12,13].
La classification de l’OMS de 2015 sépare ce groupe de tumeurs en 4 grandes catégories : les carcinoïdes typiques, les carcinoïdes atypiques, les carcinomes à petites cellules (ou CPPC) et les carcinomes neuro endocrine à grandes cellules (CNEGC) (Tableau 2) [2].
- Tumeurs carcinoïdes
Tumeur caractérisée par une architecture dite organoïde traduisant une différenciation neuroendocrine, associant des travées, un aspect insulaire, des palissades et des arrangements en rosettes.
Les carcinoïdes typiques présentent moins de deux mitoses pour 10 champs à fort grandissement et jamais de nécrose. Par contre, ils peuvent présenter des atypies cytologiques, une cellularité accrue et une invasion lymphatique.
Les carcinoïdes atypiques présentent entre deux et 10 mitoses pour 10 champs et /ou des foyers de nécrose focale.
- Carcinomes neuro endocrine à grandes cellules
Le CNEGC présente typiquement une architecture organoïde associant rosettes et palissades péri-vasculaires traduisant une différenciation neuroendocrine. L’activité mitotique est élevée (plus de 11 mitoses pour 10 champs à fort grandissement ou pour 2 mm2) et la nécrose est abondante. Ce diagnostic doit être confirmé par l’immunohistochimie ou la microscopie électronique. Les carcinomes neuroendocrines composites comportent de plus un contingent glandulaire, épidermoïde, à cellules géantes ou fusiformes, associé au contingent neuroendocrine.
- Carcinomes à petites cellules : CPC
Tumeur neuro endocrine hautement maligne, d’architecture solide, en nids, trabéculaire comportant de larges foyers de nécrose.
Les cellules sont de petite taille, < 3 lymphocytes, les limites cytoplasmiques sont imprécises avec un rapport nucléo cytoplasmique élevé (Ratio N/C haut).
Le noyau est hyperchromatique doté d’une chromatine fine granulaire. Il n’y a pas de nucléole. L’index mitotique est très élevé (Fig. 1 F).
Tableau 2 : Critères diagnostiques et système de grading des TNE du poumon selon la classification de l’OMS 2015 [2]
|
Carcinoïde Typique |
Carcinoïde Atypique |
CNEGC |
Carcinome à petites cellules |
|
|
Grade |
Bas |
Intermédiaire |
Haut |
Haut |
|
Morphologie |
TNE bien différenciée |
TNE bien différenciée |
TNE peu différenciée |
TNE peu différenciée |
|
Mitoses/2mm2 |
0-1 |
2-10 |
>10 moyenne 70 |
>10 moyenne 80 |
|
Nécrose |
Absence |
Présente (focale punctiforme) |
Présente (extensive) |
Présente (extensive) |
Autres types de carcinomes non à petites cellules
Les carcinomes adénosquameux . Ils représentent de 0,6 à 2,3% de tous les carcinomes bronchopulmonaires. Tumeurs malignes associant un contingent glandulaire et un contingent épidermoïde, chacun devant représenter au moins 10% du volume tumoral [2,14].
Les carcinomes sarcomatoïdes . Ce sont des tumeurs rares représentant moins de 3% des cancers pulmonaires et qui sont liées au tabagisme dans 90% des cas [2].
Il s’agit de carcinomes non à petites cellules, soit pléomorphes c’est à dire associant des contingents épidermoïdes, glandulaires ou à grandes cellules avec des contingents à cellules géantes et/ou à cellules fusiformes, soit de carcinomes à cellules fusiformes purs, de carcinomes à cellules géantes purs, ou encore de carcinosarcomes et de blastome pulmonaire (toujours biphasique).
Autres tumeurs du poumon
Carcinomes des glandes salivaires : carcinome muco-épidermoïde, carcinome adénoïde kystique ; ils représentent moins de 1% de l’ensemble des cancers du poumon, ils ne sont pas reliés au tabac.
Autres variantes : carcinome lymphoépithélial, il se caractérise par l’association d’une prolifération en nappes de cellules de grande taille, à noyau nucléolé, et une infiltration lymphocytaire dense. Les cellules tumorales expriment le génome de l’Epstein-Barr Virus.
Le carcinome NUT, carcinome peu différencié agressif défini par la présence du réarrangement du gène NUT (nuclear protein in testisi.e.NUTM1), il survient chez le sujet jeune.
Tumeurs non épithéliales. Outre les carcinomes pulmonaires décrits ci-dessus, d’autres types de tumeurs peuvent survenir dans le poumon, y compris les tumeurs mésenchymateuses, les tumeurs lymphohistiocytaires, le mélanome, les tumeurs germinales et autres.
Immunohistochimie
L’immunohistochimie (IHC) constitue la méthode complémentaire la plus importante pour le diagnostic et la classification du cancer du poumon. En effet grâce à l’utilisation d’anticorps spécifiques, le diagnostic anatomopathologique est porté avec précision limitant ainsi le risque d’erreur notamment sur prélèvements biopsiques.
Les marqueurs couramment utilisés pour déterminer la différenciation glandulaire incluent le TTF-1 et la Napsine A, exprimés dans plus de 85% des adénocarcinomes [15,16,17].
L’IHC permet de distinguer dans les tumeurs peu différenciées entre adénocarcinome et carcinome épidermoïde grâce à un panel d’anticorps : TTF1, Napsine A, P40, CK5/6 (Tableau 3).
Elle est également utile pour démontrer la différenciation neuroendocrine dans les tumeurs présentant une morphologie neuroendocrine. Les marqueurs neuroendocriniens couramment utilisés comprennent CD56, synaptophysine et chromogranine.
Un carcinome peu différencié négatif pour tous les marqueurs ci-dessus (immunophénotype nul) est classé comme «CPNPC, NOS» NOS : Not Otherwise Specified sur prélèvement biopsique [18].
L’IHC a un rôle dans la détermination des biomarqueurs prédictifs de réponse à la thérapie ciblée, en utilisant des marqueurs anti-ALK et anti-ROS1.
Tableau 3 : Algorithme pour le sous typage des carcinomes bronchiques non à petites cellules peu différenciés selon leur réactivité immunohistochimique dans les prélèvements biopsiques [19]
|
△NP63 (P40) |
CK5/6 |
TTF1 |
Napsine A |
Diagnostic |
|
+ |
+ |
– |
– |
Carcinome épidermoïde |
|
+ |
– |
– |
– |
Carcinome épidermoïde |
|
– |
– |
+ |
+ |
Adénocarcinome |
|
– |
– |
+ |
– |
Adénocarcinome |
|
– |
– |
– |
– |
Carcinome non à petites cellules NOS |
ΔNp63 (p40), Cytokératines (CK) 5/6, thyroid transcription factor-1 (TTF-1) and Napsine A (novel aspartic proteinase of the pepsin family)
Tests moléculaires dans le cancer du poumon
L’analyse moléculaire des anomalies génétiques a permis la compréhension des mécanismes de carcinogénèse et a apporté un changement de paradigme dans le ciblage thérapeutique et la surveillance des patients atteints de cancer pulmonaire. La détection d’altérations génétiques spécifiques s’est avérée efficace pour prédire la réponse au traitement et stratifier le pronostic [20,21].
La thérapie ciblée utilisant des molécules (substances) spécifiquement conçues pour inhiber les altérations génétiques induites par les mutations offre plus d’efficacité et moins de toxicité que les agents chimiothérapeutiques génériques et donc une amélioration substantielle des résultats par rapport à la chimiothérapie standard dans le traitement du CPNPC avancé [22].
Avec l’avènement des inhibiteurs de la tyrosine kinase (TKI), il est important de rechercher les mutations génétiques chez les patients atteints de cancer du poumon. La mutation EGFR et la translocation ALK sont les oncogènes les plus ciblés dans le CPNPC et sont maintenant réalisés en routine [23].
Le gène du récepteur de croissance épidermique l’EGF : situé sur le bras court du chromosome 7 est constitué de 28 exons (200kb) et code une glycoprotéine d’un poids moléculaire de 170 kDa. La protéine EGFR est impliquée dans les mécanismes de signalisation intracellulaire contrôlant la croissance, la survie, l’adhésion, la migration et la différenciation cellulaire.
Les mutations de l’EGFR sont responsables d’une activation des voies de signalisation à l’origine de la prolifération tumorale [24,25]. Ces mutations oncogéniques sont retrouvées au sein des exons 18 à 21 codant le domaine tyrosine kinase du récepteur. Ces mutations intéressent l’exon 19 et l’exon 21, et correspondent à des délétions de l’exon 19 (46%) et mutations de l’exon 21 L858R (39%).
Ces mutations sont rencontrées dans les adénocarcinomes, les femmes, non-fumeurs et les asiatiques [26,27].
La fréquence de l’activation de l’EGFR dans les CPNPC a permis le développement d’inhibiteurs sélectifs de la tyrosine kinase de l’EGFR (TKIs), comme le Gefitinib et l’Erlotinib. Ces médicaments permettent une survie significativement supérieure à celle observée avec les traitements standards.
La fusion du gène Anaplastic Lymphoma Kinase ALK (localisé en 2 p 23) et Echinoderm Microtubule associated proteine-Like 4 (EML4) a été identifiée dans un groupe de CPNPC, correspondant à des patients ne répondant pas à un traitement par TKI-EGFR et plus souvent non-fumeurs de sexe masculin et plus jeunes, diagnostiqués à un stade avancé.
Le type histologique correspond plus fréquemment à des adénocarcinomes bronchiques proximaux peu différenciés avec mucosécrétion, ou des carcinomes à cellules isolées en bague à chaton. Cette anomalie moléculaire est exclusive avec les mutations EGFR.
La sensibilité élective de ces patients à un traitement par Crizotinib, justifie la recherche de cette altération moléculaire, malgré la fréquence estimée entre 3% et 7% [28].
Outre l’EGFR et l’ALK, une multitude d’autres biomarqueurs sont activement évalués ou utilisés comme cibles thérapeutiques [29].
ROS1 est un récepteur tyrosine kinase qui peut être réarrangé dans 1% à 2% des adénocarcinomes pulmonaires. Le réarrangement de ROS1 est mutuellement exclusif avec les altérations d’EGFR et ALK [30]. Il a été démontré que le Crizotinib est efficace chez les patients présentant un réarrangement ROS1 et est approuvé pour un tel traitement.
La réalisation des tests moléculaires pour identifier les mutations prédictives de thérapie ciblée a fait l’objet de plusieurs actualisations par les sociétés savantes. Les guidelines de 2018 par CAP (College of American Pathologists), IASLC (International Association for the Study of Lung Cancer) et l’AMP (Association for Molecular Pathology), [31,32] recommandent :
- Les techniques d’identification des mutations doivent être suffisamment sensibles pour détecter des anomalies dans des échantillons comportant au moins 20% de cellules tumorales.
- L’hyperexpression de la protéine totale EGFR (IHC) et les variations de nombre de copies du gène EGFR (FISH) ne permettent pas de sélectionner les patients à traiter par TKI anti-EGFR.
- La détection des anomalies EGFR, ALK, ROS1 doit être faite pour tout patient atteint d’adénocarcinome à un stade avancé.
- La détection des anomalies BRAF, Her2, RAS, MET et RET peut se faire chez les patients négatifs pour les précédentes anomalies, ou si elle est incluse dans un test multiplex de type NGS
- Les techniques de séquençage multiples sont préférées à de multiples tests uniques.
- En cas de discordance, des techniques alternatives doivent être disponibles.
Conclusion
Le cancer du poumon est au 1er rang des cancers et la 1ère cause de mortalité par cancer chez l’homme dans le monde et en Algérie. Le diagnostic anatomopathologique est essentiel pour la prise en charge du patient.
L’adénocarcinome est le type histologique le plus fréquent. L’immunohistochimie aide à établir le diagnostic grâce à l’utilisation de marqueurs spécifiques : TTF1 et Napsine A pour l’adénocarcinome et P40 pour le carcinome épidermoïde, elle permet également de prédire la réponse aux thérapies ciblées grâce aux anticorps ALK et ROS1.
Les progrès réalisés dans le domaine de la biologie moléculaire grâce à l’instauration des tests moléculaires à la recherche des mutations de l’EGFR sur prélèvement biopsique est devenu indispensable, et ce dans un but de thérapie ciblée.
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin (2015) 65(2):87–108. doi:10.3322/caac.21262
- Travis WD, Brambilla E, Burke AP, Marx A, Nicholson AG. WHO Classification of Tumors of the Lung, Pleura, Thymus and Heart. 4th ed. Lyon: IARC Press ;2015.
- Lewis DR, Check DP, Caporaso NE, et al. US lung cancer trends by histologic type. Cancer 2014;120(18):2883–92.
- Oudjida F. Les altérations moléculaires dans les carcinomes bronchiques non à petites cellules. Thèse de DESM ; 2015.
- Noguchi M, Morikawa A, Kawasaki M, Matsuno Y, Yamada T, Hirohashi S, et al. Small adenocarcinoma of the lung. Histologic characteristics and prognosis. Cancer (1995) 75(12):2844–52.
- Jones KD. Whence lepidic? The history of a Canadian neologism. Arch Pathol Lab Med 2013; 137:1822–4.
- Yoshizawa A, Motoi N, Riely GJ, et al. Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma: prognostic subgroups and implications for further revision of staging based on analysis of 514 stage I cases. Mod Pathol 2011; 24(5):653–64.
- Yanagawa N, Shiono S, Abiko M, et al. New IASLC/ATS/ERS classification and invasive tumor size are predictive of disease recurrence in stage I lung adenocarcinoma. J Thorac Oncol 2013;8(5):612–8.
- Woo T, Okudela K, Mitsui H, et al. Prognostic value of the IASLC/ATS/ERS classification of lung adenocarcinoma in stage I disease of Japanese cases. PatholInt 2012;62(12):785–91.
- Lewis DR, Check DP, Caporaso NE, et al. US lung cancer trends by histologic type. Cancer 2014;120(18):2883–92.
- Travis WD, Brambilla E, Noguchi M, et al. Diagnosis of lung adenocarcinoma in resected specimens: implications of the 2011 International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification. Arch Pathol Lab Med 2013;137(5):685–705.
- Gustafsson BI, Kidd M, Chan A, et al. Bronchopulmonary neuroendocrine tumors. Cancer 2008; 113(1):5–21.
- Litzky LA. Pulmonary neuroendocrine tumors. Surg Pathol 2010; 3:27–59.
- Travis WD, Brambilla E, Muller-Hermelink HK, et al. Pathology and genetics of tumors of the lung, pleura, thymus and heart. World Health Organization classification of tumors, series 7. Lyon (France): IARC Press; 2004.
- Rekhtman N, Ang DC, Sima CS, et al. Immunohistochemical algorithm for differentiation of lung adenocarcinoma and squamous cell carcinoma based on large series of whole-tissue sections with validation in small specimens. Mod Pathol 2011;24(10):1348–59.
- Tacha D, Yu C, Bremer R, et al. A 6-antibody panel for the classification of lung adenocarcinoma versus squamous cell carcinoma. Appl Immuno histochem Mol Morphol 2012;20(3):201–7.
- Mukhopadhyay S. Utility of small biopsies for diagnosis of lung nodules: doing more with less. Mod Pathol 2012;25:S43–57.
- Mukhopadhyay S, Katzenstein AL. Subclassification of non-small cell lung carcinomas lacking morphologic differentiation on biopsy specimens: utility of an immunohistochemical panel containing TTF-1, napsin A, p63, and CK5/6. Am J Surg Pathol 2011;35(1):15–25.
- Wei Zhao, Hui Wang, Yan Peng, Bo Tian, Lei Peng, Da-Chuan Zhang. ΔNp63, CK5/6, TTF-1 and napsin A, a reliable panel to subtype non-small cell lung cancer in biopsy specimens. Int J Clin Exp Pathol 2014;7(7):4247-4253.
- Thunnissen E, van der Oord K, den Bakker M. Prognostic and predictive biomarkers in lung cancer. A review. Virchows Arch 2014;464 (3):347–58.
- Verma M. The role of epigenomics in the study of cancer biomarkers and in the development of diagnostic tools. Adv Exp Med Biol 2015; 867:59–80.
- Zheng M. Classification and Pathology of Lung Cancer. Surg Oncol Clin N Am 25 (2016) 447–468.
- Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors. Arch Pathol Lab Med 2013; 137:828–60.
- Linardou H, Dahabreh IJ, Bafaloukos D, et al. Somatic EGFR mutations and efficacy of tyrosine kinase inhibitors in NSCLC. Nat Rev Clin Oncol 2009; 6 (6): 352–66.
- Pines G, Kostler WJ, Yarden Y. Oncogenic mutant forms of EGFR: lessons in signal transduction and targets for cancer therapy. FEBS Lett 2010; 584(12): 2699–706.
- Lynch T J, Bell D W, Sordella R, et al. Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non–Small-Cell Lung Cancer to Gefitinib. N Engl J Med 2004;350:2129-39.
- Paez J G et al. EGFR Mutations in Lung Cancer: Correlation with Clinical Response to Gefitinib Therapy. Science 2004; 304: 1497-1500.
- Scott J. Rodig, Mari Mino-Kenudson, Sanja Dacic, et al. Unique Clinicopathologic Features Characterize ALK-Rearranged Lung Adenocarcinoma in the Western Population. Clin Cancer Res 2009; 15:5216-5223. Published Online First August 11, 2009.
- Rothschild SI. Targeted therapies in non-small cell lung cancer-beyond EGFR and ALK. Cancers (Basel) 2015;7(2):930–49.
- Gainor JF, Shaw AT. Novel targets in non-small cell lung cancer: ROS1 and RET fusions. Oncologist 2013;18(7):865–75.
- Lindeman N I et al. Lung Cancer Molecular Testing Guideline Update. Arch Pathol Lab Med. 2018;142:321–346; doi: 10.5858/arpa.2017-0388-CP
- Lindeman NI, Cagle PT, Aisner DL, et al. Updated molecular testing guideline for the selection of lung cancer patients for treatment with targeted tyrosine kinase inhibitors: guideline from the College of American Pathologists, the International Association for the Study of Lung Cancer, and the Association for Molecular Pathology. Arch Pathol Lab Med 2018; 142:321-46.