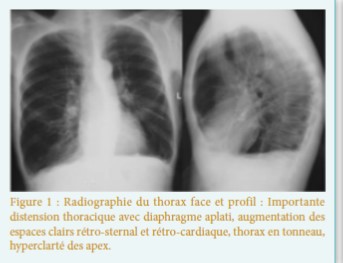
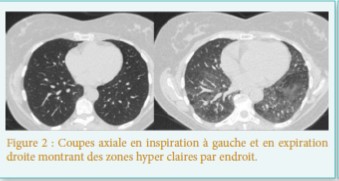
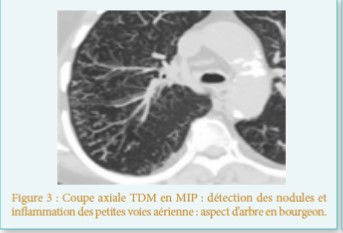
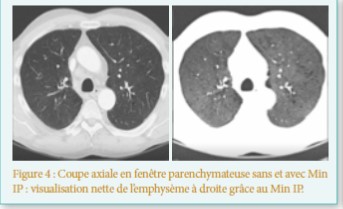
a bronchopneumopathie chronique obstructive est une pathologie multi-systémique, qui altère la qualité de vie des patients. La multiplicité des atteintes concourt à réduire leurs capacités de coping face à cette pathologie complexe.
H. Hocine, Psychiatrie, Faculté de Médecine Université Badji Mokhtar, Annaba
Date de soumission : 13 février 2021
Résumé : La bronchopneumopathie chronique obstructive est une pathologie multi-systémique, qui altère la qualité de vie des patients. La multiplicité des atteintes concourt à réduire leurs capacités de coping face à cette pathologie complexe. Les troubles psychiques sont des complications dominées par l’anxiété, la dépression et les troubles cognitifs. Les états post-traumatiques, les troubles du sommeil et de la sexualité s’articulent autour d’un vécu constant d’asthénie. Les mécanismes physiopathologiques communs à ces troubles expliquent leur intrication. L’arrêt du tabagisme est un moyen efficace pour réduire l’effet du principal facteur de risque de survenue de BPCO.
Mots clés : BPCO, qualité de vie, dépression, inflammation, tabac.
Abstract: Introduction: Chronic obstructive pulmonary disease (COPD) is a multisystem disorder which disturbs the patient’s quality of life. The aim of our focus was to describe the COPD’s impact on mental health, psychological functions and its burden on patients’ quality of life. Method: we asked Cochrane and PubMed databases in the 20 last years and obtained 905 articles. Results: COPD is a complex disease, it reduces the coping’s efficiency of the patients, by the multiple systemic dysfunctions. The psychological consequences are anxiety, depression, cognitive disorder. Post-traumatic stress disorder, sleeping and sexual disturbances are increased by long term asthenic feeling. COPD and many psychological illnesses have common mechanisms such as inflammation. Smoking cessation reduces the risk to develop COPD. Conclusion: COPD prevention depends of opting for healthy behaviours and smoking eviction.
Key words: COPD, quality of life, depression, inflammation, smoking, mental health, sleeping, sexuality.
Introduction : La bronchopneumopathie chronique obstructive (BPCO) est une pathologie chronique inflammatoire des bronches et du parenchyme pulmonaire. Elle se caractérise par un rétrécissement progressif et une obstruction permanente des voies aériennes entrainant une gêne respiratoire [1]. La surmortalité exponentielle des BPCO, en fera la 3ème cause de mortalité, en 2030 selon l’OMS [2].
Le poids des comorbidités
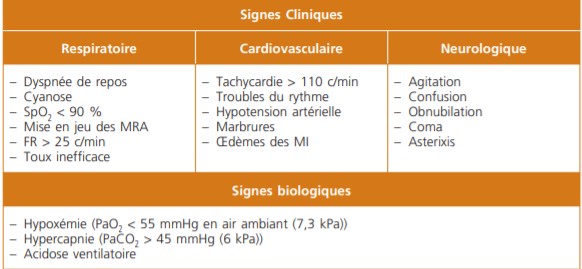
La BPCO est associée à une forte comorbidité et ne peut être considérée comme une pathologie, exclusivement pulmonaire. Les mécanismes physiopathologiques liés au stress oxydatif, aux altérations des voies de signalisations internes, ainsi qu’aux phénomènes inflammatoires qui la sous-tendent, sont systémiques [3]. Outre les effets de la Cathepsine C, au niveau local, l’augmentation du tBNF et des taux circulants de cytokines est plus marquée qu’en population générale [4]. Ce qui explique, en partie, la co-occurrence dans 97,7% des cas, de pathologies cardio-vasculaires, métaboliques, musculaires, osseuses et de troubles psychiques (53,5% des patients souffrant de BPCO ont plus de 4 comorbidités). Leur impact sur la qualité de vie est important. Chaque comorbidité rajoutée augmente le ressenti d’être en situation de soins de 43% et alourdit le poids de la pathologie sur la vie du patient [5]. Les patients souffrant de BPCO ont trois fois plus de troubles psychiques qu’en population générale [6].
Addiction tabagique et BPCO
Plusieurs étiologies génétiques et environnementales sont incriminées dans l’installation et l’aggravation des BPCO. Le tabagisme chronique, y compris passif, est le principal facteur de risque puisqu’il est associé à 80% de cas de BPCO [7]. Malgré son rôle nocif, 34 à 49% des fumeurs maintiennent cette conduite addictive après le diagnostic des BPCO [8]. Pour ces patients, la difficulté du sevrage tabagique est liée au niveau élevé de consommation, à l’ancienneté du tabagisme, à la sédentarité, au niveau socio-économique bas et à une dépendance plus élevée à la nicotine [9]. Ce maintien à la limite du suicide, interpelle les soignants et les met en échec, d’autant que les bénéfices du sevrage tabagique sur l’évolution de la BPCO sont prouvés. Certains patients, en pré-contemplation, sont dans la dénégation et minimisent l’effet du tabac. Ils sous-estiment leur capacité de résister à l’envie de fumer, et une possible amélioration suite à l’arrêt. Pour certains “c’est trop tard” [10]. Les études ont démontré l’efficacité variable des protocoles de sevrage nicotinique. Le bupropion est plus efficace que les substituts nicotiniques (patchs, gommes) au cours des BPCO [11].
Qualité de vie
La qualité de vie du patient qui souffre de PBCO est altérée directement par la dyspnée et indirectement par la convergence de troubles qui se potentialisent mutuellement [12].
La BPCO va s’interposer entre la personne et chaque activité qu’elle envisage d’accomplir, perdant la liberté d’opter pour l’intensité, le type de tel effort et la diversité de telles tâches. Il faut, constamment, choisir entre 2 activités, et anticiper la survenue d’une exacerbation au cours d’un projet. Au fil des décompensations et de l’installation insidieuse de l’asthénie, le patient se sent moins performant, ce qui le déconditionne à initier une action. Les gestes de la vie les plus anodins, sont calculés, triés pour éviter d’entamer un capital énergétique ou en oxygène en déclin constant. La vie sociale, les projets professionnels sont révisés à la lumière de la BPCO, le patient se voit progressivement contraint à renoncer à des pans entiers de son fonctionnement.
Le patient est en alarme constante. Il se sent traqué, à la merci d’un changement climatique, d’un taux d’humidité trop élevé en été et en hiver, d’une saturation de l’air par le pollen au printemps, ou d’un refroidissement annonciateur d’une surinfection en automne. Chaque saison est perçue comme un danger potentiel. Il suffoque intérieurement, par l’atrophie de son périmètre de vie autant que par la bronchoconstriction. Les hospitalisations sont des événements perturbants qui le renvoient à son incurabilité [13].
BPCO et états de stress post traumatiques (ESPT)
Chaque exacerbation est vécue comme un événement traumatisant, menaçant la vie du patient. Dans le contexte de la pandémie de la Covid-19, les patients souffrant de BPCO ont développé des tableaux liés au stress, plus marqués qu’en population générale. La prévalence de réaction de stress élevé lié au Covid-19 est de 10,6%, avec un risque d’ESPT de 11,3%. Ces patients avaient une plus grande perméabilité au stress, surtout aux menaces physiques. Le taux de dépression était estimé à 31,5% [14].
Les patients admis au service de réanimation suite à une exacerbation de leur BPCO sont plus susceptibles de développer un état de stress post traumatique (ESPT) (48%). Le risque de mort est réel ou perçu, et marque le fonctionnement du patient. L’ESPT peut modifier le pronostic de la maladie du fait de conduites d’évitement incompatibles avec une réhabilitation respiratoire. Il accroit le risque de survenue de complication addictives, dépressives ou anxieuses [15].
BPCO, dépression et anxiété
La dépression et l’anxiété sont des complications des BPCO, leurs prévalences respectives, au cours de cette pathologie, sont de 50%, 33% séparément et 43% associées [16]. Leur fréquence change d’une étude à l’autre. Pourtant, elles sont sous diagnostiquées. Seules 27-33% des dépressions sont diagnostiquées et traitées comme telles, du fait de l’hétérogénéité des outils de diagnostic et de l’absence de démarche systématique pour rechercher cette complication. D’où l’intérêt d’évaluer l’humeur des patients à l’aide de l’échelle “Depression anxiety stress scale 21” (DASS-21) qui a été validée pour le diagnostic de la dépression et des états anxieux au cours des BPCO [17]. La comorbidité, avec la dépression et l’anxiété, prolonge la durée d’hospitalisation et expose à une forte comorbidité en post-hospitalier. Les patients considèrent que la dépression et l’anxiété réduisent leurs capacités à se prendre en charge et à gérer leur BPCO [18].
Non diagnostiquée, et donc non traitée, la dépression chez les patients porteurs de BPCO contribue à l’altération de l’état de santé des patients, et influe négativement sur leurs compétences sociales. Elle accentue le sentiment de fatigue, freine le rétablissement physique et provoque une surconsommation de soins [19].
Les études sur les moyens thérapeutiques de la dépression au cours des BPCO, ont montré une meilleure tolérance des inhibiteurs spécifiques de la recapture de la sérotonine (ISRS) par rapport aux autres classes d’antidépresseurs. Les patients sont plus compliants aux thérapies cognitives et comportementales (TCC) par rapport aux traitements antidépresseurs. Les personnes d’âge avancé présentent des limites au traitement : plus impactées par la dépression mais moins sensibles aux traitements et porteuses de plusieurs comorbidités. Les traitements de la dépression apportent des bénéfices mitigés, avec une amélioration à court terme par les TCC et les antidépresseurs mais à long terme le maintien du bénéfice thérapeutique est non concluant. D’autre part, les antidépresseurs ne réduisent pas la dyspnée de la BPCO, (comparativement à leur effet sur les signes respiratoires de l’anxiété chez les patients anxieux non atteints de BPCO) [20]. De meilleurs résultats sont obtenus par l’association des TCC avec les antidépresseurs inhibiteurs sélectifs de la recapture de la sérotonine [21].
BPCO, asthénie et dénutrition
L’asthénie, symptôme transversal lié à l’hypoxémie, à la dénutrition, à la dépression, est quasi constante. La dyspnée provoque un déconditionnement de la personne à initier l’effort. La fonte musculaire entretient un sentiment constant de fatigue. Multifactorielle, cette fonte musculaire est due à la sédentarité, à la myopathie périphérique, à l’action des cytokines pro-inflammatoires TNF-? et IL-6, à la balance énergétique négative lors des exacerbations, à l’hypogonadisme qui favorise la résorption osseuse (effet de la testostérone et des œstrogènes) [22].
La dénutrition, plurifactorielle, est due à l’asthénie, aux difficultés de mastication dues à la dyspnée lors des épisodes d’exacerbation, à la perte musculaire par baisse des apports, à la réduction de l’appétit liée à une dépression ou à des perturbations de la leptine, ou par déséquilibre de la balance énergétique [23]. Les modifications d’ordre hormonal se traduisent sur le plan métabolique et constitutionnel par un aspect atrophié lié à l’hypogonadisme et, plus directement, à des troubles sexuels.
BPCO et sexualité
La sexualité est peu ou pas abordée au cours des consultations ou du suivi par le médecin traitant. Indicateur fiable du niveau d’énergie du patient et composante importante de sa vie, les tabous ou la focalisation sur des aspects techniques de l’état du patient pourraient expliquer la négligence de l’évaluation de l’activité sexuelle. Une étude a porté sur 751 patients, dont deux tiers aux stades 3 et 4 de la BPCO. Pour 67%, le score de l’échelle Arizona Sexual Experience Scale (ASEX) indique des difficultés à toutes les étapes de l’acte sexuel. Les patients se plaignent d’une baisse du désir dans 68% des cas, des troubles de l’excitation (dysfonction érectile 60% et défaut de lubrification 58% des femmes), et de l’orgasme respectivement 46% et 28% des femmes et des hommes. Ils ne sont que 6% à consulter pour ces difficultés. Seulement 10% des médecins abordent la sexualité des patients [25].
Des ajustements de l’activité sexuelles sont pointés : modifications, de la fréquence, de la durée ou des positions, recours à une pharmacothérapie pouvant aider l’acte sexuel (recours aux bronchodilatateurs pour 43% des personnes avant l’acte ou facilitateurs de l’érection pour 13% des hommes. Dans une autre étude, en réponse à un questionnaire (Index international de fonction érectile), 75% des patients atteints de BPCO de degré moyen à sévère présentent une dysfonction érectile, dont la gravité augmente avec celle de la BPCO. Un tiers des patients souffrant de BPCO a arrêté toute activité sexuelle [23].
Sommeil et BPCO
“L’overlap syndrome“ est une entité controversée, qui désigne la coexistence d’une BPCO et d’un syndrome d’apnée obstructive du sommeil. Il peut être observé dans 1% des cas de BPCO [26].
L’association des deux, expose le patient à un risque majeur de désaturation durant le sommeil, d’arythmie, d’insuffisance cardiaque droite, et d’hypertension pulmonaire [27]. Les exacerbations des BPCO seraient plus sévères et justifient des hospitalisations plus fréquentes dans l’overlap syndrome [28].
Troubles cognitifs et BPCO
La prévalence des troubles cognitifs au cours des BPCO est estimée à 36%, alors qu’en population générale, elle est de 12%. Le lien avec les BPCO est expliqué par l’hypoxie et l’hypercapnie d’une part, et par un contrôle cortical de la respiration prenant le relais de la régulation par le tronc cérébral. Les comorbidités cardiovasculaires et métaboliques contribuent au déclin cognitif [29]. La survenue de troubles cognitifs implique des mesures spécifiques pour aider les patients à adhérer au projet thérapeutique. Cependant, le dépistage de troubles cognitifs chez ces patients, répond à la même logique qu’en population générale [30].
Conclusion
Le respect des règles d’hygiène de vie, l’éviction du tabac et des polluants atmosphériques, l’inscription dans une logique durable, sont les principaux moyens de prévenir les BPCO. Les troubles psychiques concomitants, dépassent des réactions psychologiques pour s’inscrire dans un continuum physiopathologique.
Liens d’intérêts : Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références:
- C Garvey. Recent updates in chronic obstructive pulmonary disease. Post Grad Med 2016
- Mathers CD, Loncar D. Projections of Global Mortality and Burden of Disease from 2002 to 2030. PLoS Medicine. 2006 Nov28; 209–224.
- N A Negewo et al. COPD and its comorbidities Impact, measurement and mechanisms Respirology 2015
- Korkmaz et al. Therapeutic targeting of cathepsin C: from pathophysiology to treatment. Pharmacol Ther., 26 mai 2018 ; doi : 10.1016/j.pharmthera.2018.05.011
- M C Smith et al. Epidemiology and clinical impact of major comorbidities in patients with COPD Int j Chron Obstruct Pulmon Dis 2014.
- C Laurin, KL Lavoie, SL Bacon, et al (2007) Sex differences in the prevalence of psychiatric disorders and psychological distress in patients with COPD. Chest132:148–55
- M Underner M, Perriot J, Peiffer G. Sevrage tabagique du fumeur atteint de bronchopneumopathie chronique obstructive [Smoking cessation in smokers with chronic obstructive pulmonary disease]. Rev Mal Respir. 2014 Dec;31(10):937-60. French. doi: 10.1016/j.rmr.2014.07.001. Epub 2014 Aug 18. PMID: 25496790.
- Karadogan and al Factors associated with current smoking in COPD patients : cross sectional study from eastern black sea region in Turkey Tob Induc Dis. 2018.
- C A Jimenez Ruiz et al. Smoking characteristics : difference between healthy smokers and smokers with COPD. Chest 2001.
- C Liu et al. Smoking characteristics : differences in attitudes and dependence between healthy smokers and smokers with COPD different characteristics of ex-smokers and current smokers with COPD : a cross sectional study in china. Int J Chron Obstruct Pulmon Dis 2029.
- C A Jimenez- Ruiz et al Characteristics of COPD smokers and effectiveness and safety of smoking cessation medications. Nicotine Tob Res 2012
- Ninot, F. Soyez, S. Fiocco, K. Nassih, A.J.S. Morin, C. Prefaut. Le VQ11, un questionnaire de qualité de vie spécifique à la BPCO utilisable en clinique – Revue des maladies respiratoires. Doi : 10.1016/j.rmr.2010.03.020
- Hamidfar-Roy · L. Potton. Profil psychologique et qualité de vie des patients atteints d’une bronchopneumopathie chronique obstructive issus de la réanimation. Réanimation (2014) 23:S511-S516 DOI 10.1007/s13546-013-0820-6
- J C Perdozo –Pupo et al Depression perceived stress related to COVID, post-traumatic stress and insomnia among asthma and COPD patients during the COVID 19 pandemic. Chron Respir Dis/ Jan Dec 2020
- Fernandes N. Heraud La prévalence et nature de l’état de stress post-traumatique dans la bronchopneumopathie chronique obstructive (BPCO). undefined Revue des Maladies Respiratoires Volume 33, Supplement, January 2016, Page A183
- M E Kunik, K Roundy, C Veazey, et al (2005) Surprisingly high prevalence of anxiety and depression in chronic breathing disorders. Chest 127:1205–11
- Ninot (2011) Anxiety and depression in COPD: a review. Rev Mal Respir 28:739–48
- AM Yohannes et al. Validity and responsiveness of the depression anxiety stress scales 21 (DASS-21) in COPD Chest 2019 PMID 30594559.
- Pooler et al. Int Examining the relationship between anxiety and depression and exacerbations of COPD which result in hospital admission: a systematic review Chron Obstruct Pulmon Dis. 2014. PMID 24729698
- AM Yohannes AM et al. Depression and anxiety in patients with COPD. Eur Respir Rev. 201.4 PMID 25176970.
- M J Connolly et al. the impact of depression in older patients with COPD and asthma Maturitas. 2016.
- A Fritzsche et al. Effects of medical and psychological treatment of depression in patients with COPD a review Respir Med 2001
- Gayan Ramirez M Decramer. Myopathie périphérqiue des BPCO Rev Med Suisse 2002 volume -2.22085
- Coronado J.-W. Fitting. Effets extrapulmonaires de la bronchopneumopathie chronique obstructive. Rev Med Suisse 2005; volume 1. 30747
- Mihalache, J-W Fitting, L P. Nicod [24]. La bronchopneumopathie chronique obstructive et son lien avec les facteurs de risque cardiovasculaires. Rev Med Suisse 2015; volume 11. 2151-2156
- Le Guillou M.H. Colson, C. Pochulu, R. Escamilla, D. Piperno, J. Pon, C. Raherison-Semjen Sexualité et BPCO. Revue des maladies respiratoires actualités. Doi : 10.1016/j.rmra.2019.11.203
- R Lee, WT McNicholas. Obstructive sleep apnea in chronic obstructive pulmonary disease patients. Curr Opin Pulm Med. 2011 Mar;17(2):79-83. doi: 10.1097/MCP.0b013e32834317bb. PMID: 21169840.
- M Shteinberg, D Weiler-Ravel, Y Adir [The overlap syndrome: obstructive sleep apnea and chronic obstructive pulmonary disease]. Harefuah. 2009 May;148(5):333-6, 348. Hebrew. PMID: 19630366.
- JM Marin, JB Soriano, SJ Carrizo, A Boldova, BR Celli. Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome. Am J Respir Crit Care Med. 2010 Aug1;182(3):325-31. doi: 10.1164/rccm.200912-1869OC. Epub 2010 Apr 8. PMID: 20378728.
- Lawi, G. Berra, J-P Janssens, PM. Soccal, D. Adler. BPCO et troubles cognitifs. Rev Med Suisse 2018; volume 14. 2066-2069
- MM Dulohery, DR Schroeder, RP Benzo. Cognitive function and living situation in COPD: is there a relationship with self-management and quality of life? Int J Chron Obstruct Pulmon Dis. 2015 Sep 10;10:1883-9. doi: 10.2147/COPD.S88035. PMID: 26392762; PMCID: PMC4573196.