Les marqueurs tumoraux sont des substances présentes dans le sang (ou éventuellement les urines), des malades cancéreux de façon anormale, et qui signent de façon plus ou moins spécifique la présence de cancer
04 Août 2018
F. Hadjarab, K. bouzid,
Centre Pierre & Marie Curie, Alger.
Résumé
Les marqueurs tumoraux sont des substances présentes dans le sang (ou éventuellement les urines), des malades cancéreux de façon anormale, et qui signent de façon plus ou moins spécifique la présence de cancer. Cet examen peut s’avérer utile à différentes étapes de la prise en charge : du diagnostic du cancer à l’évaluation de l’efficacité du traitement, ou encore lors du suivi des patients, et permet ainsi d’estimer le risque de récidive. Dans cet article nous aborderons les marqueurs tumoraux, ainsi les tumeurs concernées pour chacun d’eux et leur utilité en pratique clinique ; ainsi que l’expérience du service d’oncologie médicale concernant les marqueurs tumoraux utilisés dans le cancer de l’ovaire notamment les CA125 et CA199.
Mots-clés :
Marqueurs tumoraux, diagnostic du cancer, suivi, rechute.
Abstract
Tumor markers are substances abnormally present in the blood (or possibly the urine), of cancer patients, which indicates more or less specifically the presence of cancer. This test can be useful at different stages of the treatment: from the diagnosis of the cancer to the evaluation of the effectiveness of the treatment, or during the follow-up of the patients, and thus makes it possible to estimate the risk of relapse. In this article we will discuss the tumor markers, the tumors involved for each of them and their usefulness in clinical practice; as well as the experience of the medical oncology department concer- ning tumor markers used in ovarian cancer, in particular CA125 and CA199.
Key-words :
Tumor markers, cancer diagnosis, follow-up, relapse.
Introduction
Les marqueurs tumoraux sont des substances présentes dans le sang (ou éventuellement les urines) des malades cancéreux de façon anormale, et qui signent de façon plus ou moins spécifique la présence de cancer. Mais ils peuvent aussi être fabriqués par le corps lorsqu’une tumeur se développe, ou par les cellules cancéreuses elles-mêmes. Les marqueurs tumoraux peuvent êtres spécifiques à certains cancers, ou communs à différents cancers. Il faut savoir que le dosage de certains marqueurs tumoraux peut être élevé sans mise en évidence systématique d’une affection cancéreuse sous-jacente.
Ces analyses sont souvent complétées par différents examens pour confirmer le diagnostic d’un cancer comme l’échographie, le scanner, l’I.R.M., la scintigraphie, la radiographie ; parfois la fibroscopie et l’indispensable biopsie.
Comment détecter les marqueurs tumoraux
Les marqueurs tumoraux sont habituellement détectés dans le sang, dans les urines, dans les tumeurs et autres tissus du corps, à l’occasion d’un bilan biologique.
Utilité du dosage des marqueurs tumoraux
Le dosage des marqueurs tumoraux peut être utile à différents stades de la prise en charge d’un cancer : pour son dépistage, son diagnostic, la détermination du son stade (propagation) ou de son pronostic (agressivité de la tumeur). Il est également utile pour choisir et surveiller le traitement, évaluer son efficacité (réponse) ou encore pour estimer le risque de récidive.
A. Pour dépister la maladie ?
L’utilisation d’un marqueur pour le dépistage n’est guère envisageable. Même un marqueur très sensible (90 %) et très spécifique (90 %) ne permet pas en effet, une détection efficace.
Actuellement, une telle attitude n’est recommandée pour aucune pathologie, compte tenu des risques encourus par les sujets bien portants inutilement testés et du coût d’une telle attitude. Le dosage du PSA au cours du cancer de la prostate fait peut-être exception.
Le dosage de certains marqueurs tumoraux pourrait avoir un intérêt pour la détection précoce d’un cancer chez les populations à haut risque, comme par exemple le dosage de la thyrocalcitonine dans les cancers médullaires de la glande thyroïde, ou la mesure de l’AFP pour détecter la survenue d’un cancer du foie (hépato carcinome) chez des patients souffrant de cirrhose.
B. Pour diagnostiquer la maladie ?
Un dosage élevé d’un marqueur tumoral ne sert pas à faire le diagnostic de cancer. Aucune équipe médicale ne mettra en place un traitement uniquement basé sur une élévation du taux de marqueurs tumoraux en dehors de cas très précis.
Dans un contexte clinique évocateur comme une grosse prostate, des lésions osseuses, l’élévation du PSA est importante pour le diagnostic de cancer de la prostate.
Chez un homme jeune, l’existence de métastases gan- Foie glionnaires ou pulmonaires, un dosage élevé d’AFP ou de bêta-HCG est évocateur d’un cancer du testicule. AFP Testicule
C. Pour préciser le pronostic de la maladie ?
Le dosage des marqueurs tumoraux a un intérêt certain. Ovaire Il permet de juger l’importance de l’extension tumorale et parfois faire le diagnostic d’une extension de la mala- CA 125 Endomètre die non encore visible en imagerie médicale. CA 15-3 Sein 1
<p À titre d’exemple, le dosage des marqueurs tumoraux est important dans le suivi du cancer du testicule et pour affirmer sa guérison. p>
D. Évaluer l’efficacité des traitements ?
C’est un bon moyen, simple, pour suivre l’efficacité du traitement mis en œuvre.
La connaissance de l’évolution du taux de marqueurs tumoraux est importante. Une normalisation du taux des marqueurs tumoraux, lorsqu’il était élevé, après untraitement local (chirurgie) est un argument pour dire que la tumeur a été complètement enlevée.
E. Pour le suivi après traitement afin de détecter précocement une rechute éventuelle ?
Le dosage des marqueurs tumoraux est utile car une élévation précède en moyenne de 6 mois l’apparition de lésions visibles.
Cette élévation constitue souvent le premier signe de rechute avant les signes cliniques et d’imagerie médicale
Cette information est très importante pour certaines localisations comme le cancer du testicule ou le cancer
de la thyroïde, car l’instauration rapide d’un traitement approprié permet d’obtenir une guérison.
F. La répétition des dosages :
Il n’a pas encore démontré s’il est utile de traiter les malades au moment de leur rechute biologique ou au moment de leur rechute clinique.
Comme nous ne savons pas quelle est la meilleure attitude, il n’est pas sûr que l’attitude trop fréquemment rencontrée de doser très régulièrement les marqueurs, à chaque visite de surveillance, soit vraiment utile ; ni sur le plan de la thérapeutique, ni sur le plan psychologique.
La surveillance clinique est souvent suffisante.
Tableau 1 : Utilité des marqueurs tumoraux/Localisations tumorales
G. Variations des marqueurs tumoraux selon le stade
Le niveau du marqueur reflète en général, la masse tumorale : le taux est plus constamment augmenté au cours des formes évoluées qu’au cours des formes débutantes, et il augmente avec la progression de la maladie.
L’élévation très importante de l’ACE1 est en rapport avec le stade des cancers coliques : un taux bas fait présager une évolution locale, un taux élevé fait craindre la présence de métastases ganglionnaires voire d’une métastase hépatique. Cette notion est utilisée au cours de la discussion du traitement des cancers de la prostate, apparemment localisés. Un taux élevé de PSA fait craindre une atteinte tumorale. Au delà de 30 ng/ml, il est peu probable que le cancer soit limité à la prostate.
 Tableau2:Variationsdesmarqueurstumoraux
Tableau2:Variationsdesmarqueurstumoraux
 Tableau 3 : Variations des marqueurs tumoraux PSA ACE selon le stade selon le stade et score de Gleason.
Tableau 3 : Variations des marqueurs tumoraux PSA ACE selon le stade selon le stade et score de Gleason.
H. Valeur pronostique initiale des marqueurs tumoraux :
Le niveau initial d’un certain nombre de marqueurs, possède un certaine valeur pronostique.
Chez les patients atteints d’un cancer métastatique de la prostate, le taux initial avant hormonothérapie permet d’évaluer les possibilités de rémission. De même, le taux initial du dosage de la b-HCG et des a-fœto-protéine dans les tumeurs du testicule avec métastases est un facteur de pronostic important.
I. Valeur pronostique évolutive des marqueurs tumoraux :
Un facteur important de pronostic est la diminution du taux du marqueur en cours de traitement.
Dans les adénocarcinomes de l’ovaire, une absence de retour à la normale du Ca 125 après 3 cures de chimiothérapie signe une résistance à la chimiothérapie.
Une chute trop lente de la -HCG ou de l’AFP dans les tumeurs testiculaires prédit un non succès de la chimiothérapie.
J. Prédiction de la rechute des marqueurs tumoraux :
L’étude prolongée des taux de Ca 125 permet de prédire la rechute des cancers de l’ovaire, 6 mois à un an avant l’apparition des signes cliniques.
Les difficultés psychologiques engendrées par les varia- tions non significatives du Ca 125 peuvent pousser à une attitude de non-dosage systématique. Ainsi, l’utilité de la prédiction de la rechute est discutable.
Bien que sur le plan pratique, nous ayons remarqué que pour les tumeurs sécrétantes (séreuses), dès qu’il y a réascension des CA125, quelques mois après, les lésions de rechutes apparaitront à l’imagerie (TDM ou IRM).
Caractéristiques des marqueurs tumoraux
Le marqueur idéal devrait avoir une capacité de discri- mination complète grâce à d’excellentes spécificité et sensibilité, permettant des valeurs prédictives positives et négatives maximales. Il devrait également avoir un faible coût. Mais ce marqueur idéal n’existe pas !
La sensibilité d’un test est la probabilité que ce test soit positif si la personne est atteinte de la maladie,
La spécificité d’un test est la probabilité que ce test soit négatif si la personne testée est indemne de la maladie,
La valeur prédictive positive (VPP) est la probabilité positive que le patient, dont le test est positif, soit effectivement malade,
La valeur prédictive négative (VPN) est la probabilité négative que le patient, dont le test est négatif, ne soit pas malade.
Les principaux marqueurs tumoraux :
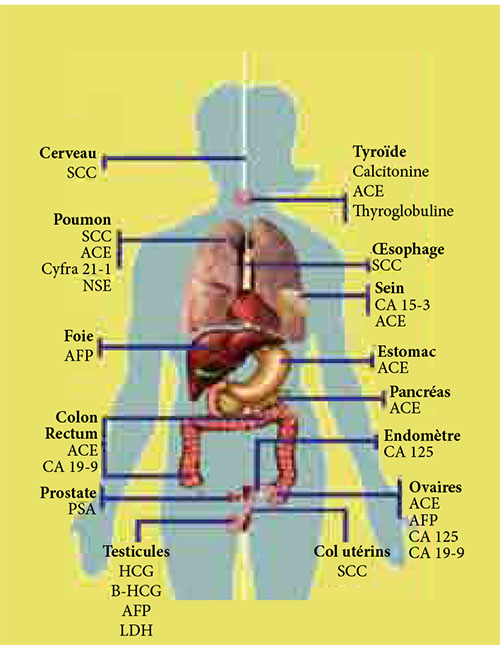
Parmi les marqueurs utilisés couramment en oncologie, on distingue les marqueurs dits «classiques», pour la plupart, des protéines sériques et les marqueurs moléculaires tissulaires. Schéma montrant marqueurs tumoraux selon localisation tumorale.
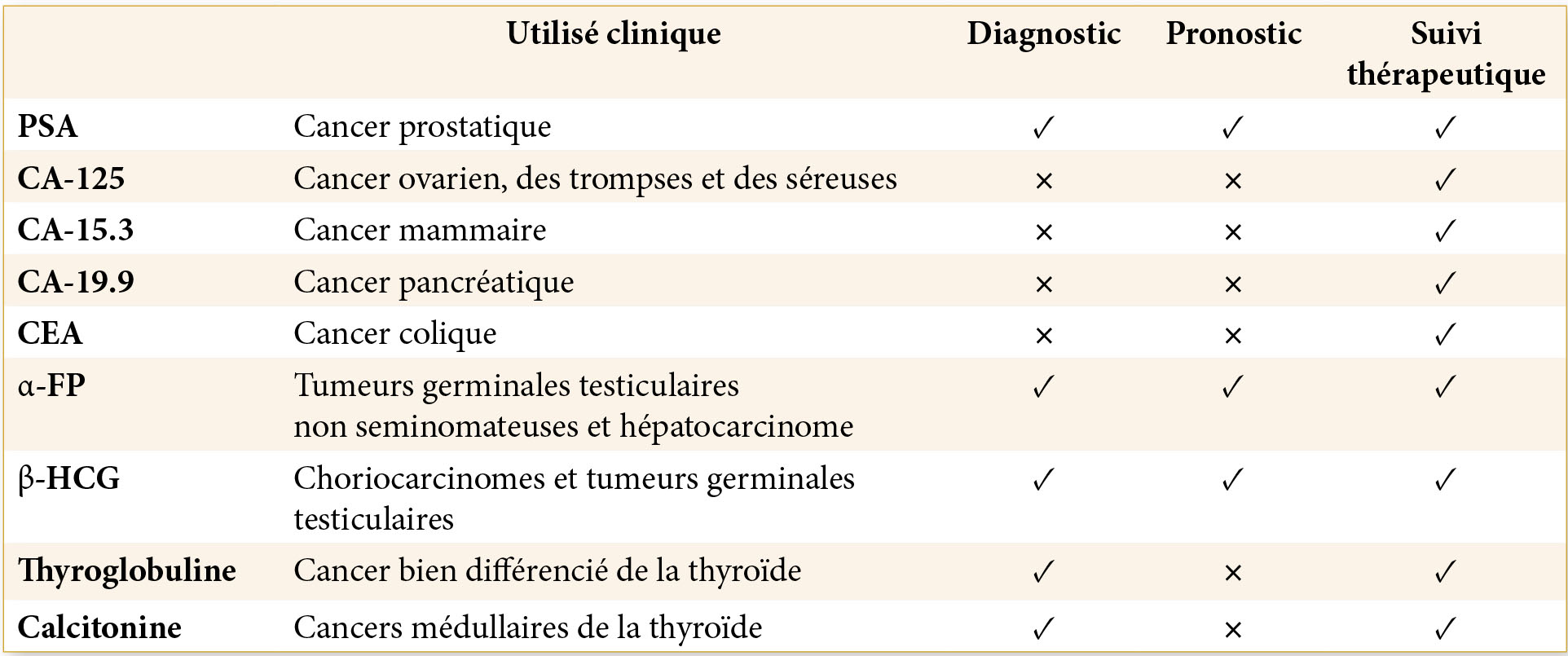 Tableau 4 : Marqueurs classiques utiles au suivi thérapeutique en situation métastatique.
Tableau 4 : Marqueurs classiques utiles au suivi thérapeutique en situation métastatique.
A. Marqueurs tumoraux classiques
 a. Antigène prostatique spécifique (PSA) :
a. Antigène prostatique spécifique (PSA) :
L’antigène prostatique spécifique (APS) est une protéine naturellement fabriquée par les cellules de la prostate.
Un dosage sanguin permet de mesurer la quantité d’APS dans le sang. Il est utile au dépistage du cancer de la prostate en présence de facteurs de risques (âge, antécédents) ou de symptômes évocateurs. Il présente également un intérêt pour évaluer l’efficacité du traitement et surveil- ler une éventuelle récidive. À noter que seulement 1 homme sur 4 dont le taux de PSA est anormal est atteint du cancer de la prostate. Son taux doit être inférieur à 2,5 nanogrammes/ml. Le taux n’est significatif qu’au-dessus de 15 à 20 nanogrammes.
b. Gonadotrophine chorionique humaine (HCG) :
Cette hormone est produite naturellement par le placenta lors de la grossesse. Elle est aussi fabriquée par certaines cellules cancéreuses. Le dosage de la gonadotrophine chorionique humaine (HCG ou BHCG) participe au diagnostic de certains cancers.
Elle est augmentée au cours de tumeurs trophoblastiques gestationnelles, de tumeurs placentaires et de tumeurs testiculaires non séminomateuses (choriocarcinomes), et le cancer de l’ovaire (tumeur germinale). Ce dosage aide également à évaluer l’efficacité thérapeutique du traitement.
La demi-vie plasmatique de la b-HCG est de 36 à 48 heures, permettant de suivre de près l’évolution sous traitement. Hors grossesse, le taux normal, d’HCG se situe à moins de 5 unités internationales/litre.
c. Alfa-fœtoprotéine :
L’alpha-fœtoprotéine (ou AFP) C’est une a1-globuline pro- duite par le foie fœtal, le tractus intestinal et le sac vitellin.
La protéine est normalement présente dans la circulation fœtale, et semble jouer le même rôle que celui de l’albumine chez l’adulte. Son taux doit être inférieur à 8 nanogrammes/ml.
Le taux significatif est au-dessus de 8 à 10 nanogrammes/ml.
Son dosage permet d’étayer le diagnostic de cancers digestifs (cancer du foie – le carcinome hépatocellulaire – ou métastase au foie, cancer de l’estomac, cancer du pancréas, cancer des canaux biliaires) ; d’un cancer de l’ovaire (les tumeurs germinales comme les tumeurs vitellines), ou d’un cancer des testicules.
d. Antigène carbohydrate 19-9 (CA19-9) :
L’Antigène carbohydrate est une protéine présente chez les adultes en bonne santé dans le foie, le pancréas, les poumons et la vésicule biliaire. La présence du CA 19-9 en quantité supérieure à la normale dans le sang n’est pas forcément synonyme de cancer.
Elle peut également permettre le diagnostic d’affections bénignes comme : une inflammation du pancréas ou de la vésicule biliaire, des calculs biliaires, une cirrhose ou une hépatite, une fibrose kystique. Son taux doit être inférieur à 37 UI/ml mais n’est significatif qu’au-dessus de 60 UI/ml.
Son dosage permet d’étayer le diagnostic de cancers digestifs (du pancréas, surtout lorsque le cancer est avancé) ; du foie, le cancer colorectal, le cancer de l’estomac ou des canaux biliaires) ; les cancers gynécologiques comme celui de l’ovaire, de l’utérus, du sein, et le cancer du poumon.
e. Antigène tumoral 15-3 (CA15-3) :
LE CA15-3 est un marqueur assez spécifique du can- cer du sein. Son taux peut néanmoins être augmenté en présence d’autres cancers : cancers de l’ovaire, du foie et parfois du poumon. Le dosage sanguin du CA15-3 est généralement réalisé pour vérifier l’efficacité thérapeutique du traitement du cancer du sein, ou dépister une récidive après la mise en œuvre du traitement.
Cette protéine sert essentiellement au dépistage et au suivi du cancer du sein. L’augmentation de son taux peut être due à des affections bénignes comme l’endométriose, un kyste du sein ou des ovaires, des troubles du foie. Le CA15-3 sert au diagnostic et au suivi du cancer du sein, du cancer de l’ovaire, du cancer des poumons, des cancers digestifs (pancréas, estomac, et foie). Son taux doit être inférieur à 30 UI/ml. Le taux significatif est au-dessus de 30 UI/ml.
f. Antigène tumoral 125 (CA125)
Le dosage sanguin du CA125 est prescrit pour le suivi des cancers de l’ovaire afin de vérifier la réponse au traitement et dépister une récidive après le traitement. Il peut également être prescrit si une patiente présente des signes évoquant une autre affection cancéreuse.
Son taux doit être inférieur à 35 UI/ml, mais n’est significatif qu’au-dessus de 40 UI/ml. Le CA125 permet d’aiguiller vers un diagnostic notamment les cancers gynécologiques (cancer des ovaires : c’est l’un des marqueurs de référence pour plusieurs types de tumeurs de l’ovaire), les tumeurs de l’utérus et du col de l’utérus, du sein ; mais aussi des cancers digestifs : cancer de l’estomac, cancer colorectal, cancer du foie) ; ou encore cancer du poumon, et vers certaines pathologies bénignes.
 Tableau 5 : CA125/Tissuetpathologiescancéreuses
Tableau 5 : CA125/Tissuetpathologiescancéreuses
 Tableau 6 : CA125 et pathologies bénignes et cancéreuses
Tableau 6 : CA125 et pathologies bénignes et cancéreuses
g. Antigène carcino-embyonnaire (ACE)
C’est une glycoprotéine retrouvée dans le tractus alimentaire, le foie et le pancréas du fœtus entre le 2ème et le 6ème mois de la vie intra-utérine. Le dosage de l’ACE est principalement prescrit pour aider au diagnostic du cancer colorectal et surveiller la réponse au traitement.
Son taux doit être inférieur à 5 nanogrammes/ml. Le taux n’est significatif qu’au-dessus de 10 à 20 nanogrammes/ml, les néoplasies concernés sont les cancers digestifs (cancer colorectal, c’est l’un des marqueurs de référence pour certaines tumeurs du côlon, du cancer de l’estomac, du cancer du pancréas, du cancer du foie).
Un taux anormalement élevé d’ACE ne signifie pas forcément « cancer ».
Le taux d’ACE peut en effet augmenter en cas d’affections bénignes comme des troubles du foie, une maladie pulmonaire chronique, une colite ou une inflammation de l’intestin, ou encore une inflammation du pancréas. Autres cancers (cancer de la thyroïde, cancer des ovaires et du sein, cancer de la vessie).
h. Le CA50 :
C’est un marqueur des tumeurs du tube digestif, de l’ovaire, et de l’utérus. Son taux doit être inférieur à 15 UI/ml. Le taux significatif est au dessus de 15 UI/ml.
i. Le CA549 :
C’est un marqueur de certains cancers du sein. Son taux doit être inférieur à 12 UI/ml et il est significatif au- dessus de 12UI/ml.
j. La Thyrocalcitonine
Produite par la thyroïde, elle est fabriquée en excès dans certaines maladies, dont le cancer médullaire de la thyroïde. Sa mesure contribue au diagnostic de ce cancer, mais permet également de juger de l’efficacité de son traitement ou de la survenue de rechute, les cancers concernées sont le cancer médullaire de la thyroïde, les métastases osseuses hypercalcémiantes ou sécrétion ectopique (par une tumeur du sein, du poumon, de l’intestin, du pancréas, phéochromocytome, tumeur de la surrénale) ; le cancer hépatique ou la cirrhose du foie, l’insulinome (tumeur neuroendocrine du pancréas), VIPome une tumeur neuroendocrine très rare (en anglais VIP pour « vasoactive intestinal peptide »). Les taux normaux sont < 10 ng/L. En cas d’insuffisance rénale, les résultats doivent être inférieurs à 50 ng/L. Après injection de pentagastrine (et une fonction rénale normale), les concentrations doivent être inférieurs à 30 ng/L.
k. Les productions ectopiques d’hormone
Les cancers du poumon, et notamment la forme dite à petites cellules, sont souvent associés à la production ec- topique d’hormone : ACTH, calcitonine, ADH. Il s’agit, le plus souvent, de fragments protéiques sans fonction hormonale (sauf l’ADH produisant un syndrome d’hyponatrémie avec œdème).
l. Les phosphatases acides prostatiques
Fabriquées par les cellules normales prostatiques, elles sont élevées lors de la diffusion métastatique. Leur rôle, comme marqueur, a beaucoup perdu de son intérêt depuis la mise en évidence du PSA (cf. plus loin). Les phosphatases acides prostatiques ont un taux qui doit être inférieurs à 3 ng/ml. Le taux n’est significatif qu’au dessus de 5 à 10 ng/ml.
m. Les phosphatases alcalines
Il existe un certain nombre d’isoenzymes : foie, os, placenta, qui sont souvent augmentés en cas de métastases hépatiques ou osseuses.
n. L’isoenzyme placentaire
Elle est retrouvée dans certaines tumeurs ovariennes ou testiculaires.
o. La lacticodeshydrogénase (LDH)
Il s’agit en principe d’une enzyme musculaire, mais son élévation est retrouvée en cas de lymphome ou de métastases pulmonaires.
p. L’énolase neurone spécifique (NSE)
Cette enzyme est assez souvent élevée dans le plasma des malades atteints de cancer du poumon à petites cellules. Son taux doit être au-dessous de 15 ng/ml. Le taux significatif est au-dessus de 15 ng/ml.
q. Le TPA (Tissu Peptide Antigène) monoclonal
C’est un nouveau marqueur intéressant dans le suivi des malades atteints de cancer du sein, du poumon et de la vessie.
r. Enfin un nouveau marqueur (CYFRA 21-1),
C’est le plus sensible dans le cancer pulmonaire. Sa sensibilité est meilleure que l’ACE et le NSE, son taux est corrélé à la taille de la tumeur et à la progression de la maladie. La persistance du taux de CYFRA 21-1 après un traitement est significative de la présence de métastases.
Ce marqueur peut être retrouvé à des taux faibles dans certaines maladies : cirrhoses, hépatites, affections gynécologiques, insuffisance rénale chronique, et dans des affections pulmonaires bénignes. Le taux normal est inférieur à 33 microgrammes/litre.
B. Marqueurs moléculaires tissulaires
La carcinogenèse est un processus compliqué qui implique le dysfonctionnement d’un ou plusieurs composants cellulaires. Leur identification donne naissance à des marqueurs moléculaires tissulaires. Ces marqueurs, dont le nombre ne cesse d’augmenter, sont le fruit des remarquables progrès en biologie cellulaire.
A l’état physiologique, une cellule reçoit des informations de son environnement grâce à l’interaction entre des récepteurs transmembranaires et leurs ligands (molécules extracellulaires).
Cette information est transmise au noyau des cellules par l’intermédiaire de multiples protéines organisées en cascades intracellulaires dans ce qui est appelé les voies de signalisation intracellulaire.
Ces protéines transmettent l’information grâce à leur activité enzymatique de type kinase, c’est à dire leur propriété de catalyser le transfert d’un groupe phosphate de l’ATP (adénosine triphosphate) sur la tyrosine (on parle alors de tyrosine kinase) ou la sérine ou thréonine (on parle de sérine thréonine kinase) d’autres protéines en aval de la cascade (figure 1).
Dans une cellule tumorale, l’activité des récepteurs transmembranaires ou des protéines intracellulaires peut être augmentée par surexpression ou mutation, créant des conditions propices à la prolifération de la cellule, à sa survie, ou encore induisant des propriétés d’invasion ou de métastatisation (figure 2).
Toutes ces anomalies deviennent autant de marqueurs moléculaires potentiels et donc potentiellement des facteurs pronostiques ou prédictifs, ainsi que des cibles thérapeutiques. Nous allons prendre comme exemple la famille des récepteurs du facteur de croissance épidermique (EGFR).
Cette famille comprend quatre types de récepteurs transmembranaires avec activité de tyrosine kinase : EGFR (cErbB1), Her2/neu (cErbB2), Her3 (cErbB3) et Her4(cErbB1)
|
|
|
a. Epidermal growth factor receptor (EGFR) :
L’EGFR peut être surexprimé dans de nombreux cancers solides comme les cancers du poumon non à petites cellules (NSCLC), les cancers colorectaux et ceux de la sphère ORL. C’est un marqueur prédictif de réponse aux thérapies ciblées le visant, telles que les anticorps monoclonaux cétuximab ou panitumumab pour le cancer colorectal. L’activité de l’EGFR peut aussi être augmentée par une mutation de son gène.
Ainsi, entre 10 et 15 % des patients caucasiens et 40 % des patients asiatiques atteints de NSCLC (souvent des non fumeurs) présentent à leur surface un récepteur EGFR muté. Cette mutation permet une auto activation du récepteur et de sa voie de signalisation (indépendamment d’un ligand) ou son activation par d’autres ligands, amenant à la prolifération anarchique de la cellule.
Plusieurs médicaments, appelés inhibiteurs des tyrosines kinases, permettent de bloquer ce mécanisme. Deux sont déjà commercialisés : le géfitinib (Iressa®) et l’erlotinib (Tarceva®).
L’étude européenne EURTAC a comparé les effets de l’erlotinib à ceux d’une chimiothérapie classique dans les cancers du poumon avancés et non opérables. La médiane de survie sans progression, c’est à dire le temps pendant lequel la maladie est contrôlée, était de 5,2 mois sous chimiothérapie et de 9,7 mois sous erlotinib.
Cela représente une diminution du risque de progression de 63% grâce à l’erlotinib. Cette étude a donc montré que l’erlotinib, donné en première intention chez les porteurs de la mutation EGFR, contrôle mieux la maladie que la chimiothérapie classique.
L’apparition de résistances en cours de traitement ou l’absence primaire de réponse aux thérapies ciblées contre l’EGFR ont poussé la recherche vers les voies de signalisation cytoplasmiques en aval de l’EGFR. Ainsi, dans la voie RAS/RAF/MAPK, on a identifié des mutations activatrices du KRAS ou BRAF dans respectivement 40 et 20 % des carcinomes coliques et dans 40 et 2 % des NSCLC.
Elles confèrent une résistance de ces cancers aux traitements anti EGFR. Ces deux mutations sont mutuellement exclusives, ce qui implique que la mutation BRAF ne sera testée qu’en cas d’absence de mutation KRAS.
b. Human epidermal growth factor receptor-2 (Her2/neu)
Le Her2/neu est surexprimé dans 20 à 25% des carci- nomes mammaires. Il est associé au comportement agressif de ces cancers qui deviennent rapidement métastatiques et dont la survie globale est réduite. L’altération du Her2 peut être mise en évidence par la recherche d’une surexpression par immunohistochimie (IHC) ou en évaluant l’amplification de son gène par des techniques d’hybridation in situ (FISH) sur du tissu tumoral.
Plusieurs médicaments ont été développés pour cibler Her2. Le premier d’entre eux est l’anticorps monoclonal trastuzumab (Herceptin®).
En association avec la chimiothérapie, cet anticorps améliore très nettement le devenir des patientes souffrant de cancer du sein Her2r, que ce soit aux stades localisés ou en situation métastatique.
Plus récemment, d’autres molécules ciblant Her2 ont démontré leur efficacité comme les anticorps monoclonaux pertuzumab, le TDM1 (qui est une combinaison du trastuzumab avec une chimiothérapie) ou encore le lapatinib, un inhibiteur des tyrosines kinases agissant sur le versant intracellulaire du récepteur. Une fraction des cancers gastriques exprime également Her2, rendant attractive l’utilisation du trastuzumab. En situation métastatique, l’étude de phase III ToGA a démontré un taux de réponses supérieur (47 % vs 35 %) et une survie médiane prolongée (13,8 mois vs 11,1 mois) pour les patients traités par la combinaison trastuzumab et chimiothérapie traditionnelle à base de 5FU et cisplatine.
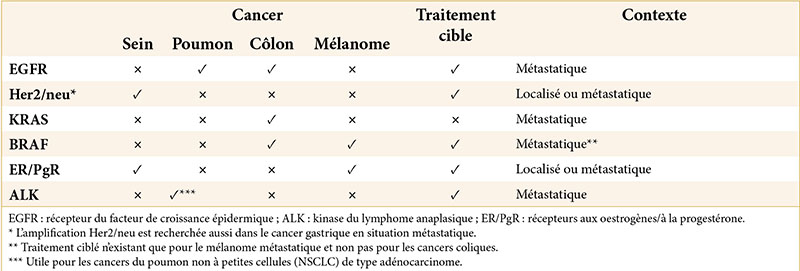 Tableau 7 : Principaux bio marqueurs utilisés en oncologie
Tableau 7 : Principaux bio marqueurs utilisés en oncologie
Conclusion
Les marqueurs tumoraux des cancers sont nombreux. Ils jouent un rôle important dans la surveillance des cancers au cours du traitement et durant leur suivi à long terme. Ils constituent une aide au diagnostic pour certains cancers (prostate, tumeurs germinales ovarienne et testiculaire, choriocarcinome, hépatocarcinome). Ils sont aussi parfois des facteurs pronostiques et/ou prédictifs.
La meilleure compréhension des voies de la carcinogenèse permet une classification moléculaire des cancers et le développement de thérapies ciblées. Cependant leur intérêt dans le dépistage et le diagnostic reste limité du fait de leur spécificité qui n’est jamais absolue.
Date de soumission :
04 Août 2018.
Liens d’intérêts :
Les auteurs déclarent ne pas avoir de liens d’intérêts
Références :
- Locker GY, Hamilton S, Harris J, et al. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer. J Clin Oncol 2006; 24:5313-27.
- Duffy MJ, van Dalen A, Haglund C, et al. Clinical utility of biochemical markers in colorectal cancer: European Group on Tumour Markers (EGTM) guidelines. Eur J Cancer 2003; 39:718-27.
- Baselga J. The EGFR as a target for anticancer therapy – focus on cetuximab. Eur J Cancer 2001;37(Suppl. 4): S16-22.
- Shigematsu H, Lin L, Takahashi T, et al. Clinical and biological features associated with epidermal growth factor receptor gene muta- tions in lung cancers. J Natl Cancer Inst 2005; 97:339-46.
- Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation positive non-small-cell lung cancer (EUR- TAC) : A multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13:239-46.
- De Roock W, Piessevaux H, De Schutter J, et al. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol 2008;19: 508-15.
- De Roock W, Claes B, Bernasconi D, et al. Effects of KRAS, BRAF, NRAS, and PIK3CA mutations on the efficacy of cetuximab plus che- motherapy in chemotherapy-refractory metastatic colorectal cancer: A retrospective consortium analysis. Lancet Oncol 2010;11: 753-62.
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al. Trastuzu- mab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005;353: 1659-72.
- Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): A phase 3, open-label, randomised controlled trial. Lancet 2010; 376:687-97
- A. Sarivalasis M.-L. Amram P.-Y. Dietrich : Marqueurs tumoraux : quelle utilité en pratique clinique ? Revue Médicale Suisse – www. revmed.ch – 22 mai 2013 Rev Med Suisse 2013; 9 : 1102-7


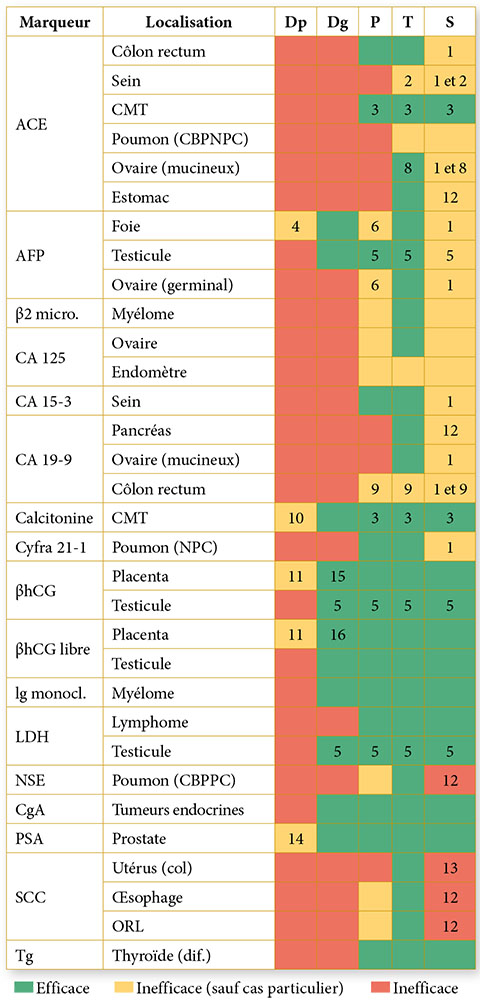
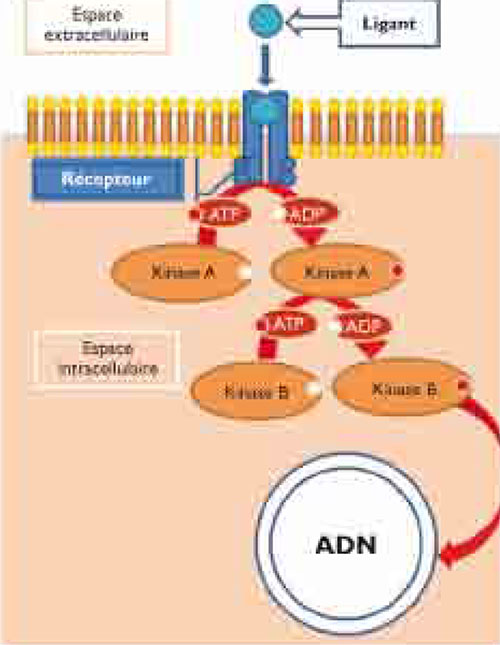 Figure 1 : Récepteurs à activité enzymatique de type kinase et cascade de signalisation
Figure 1 : Récepteurs à activité enzymatique de type kinase et cascade de signalisation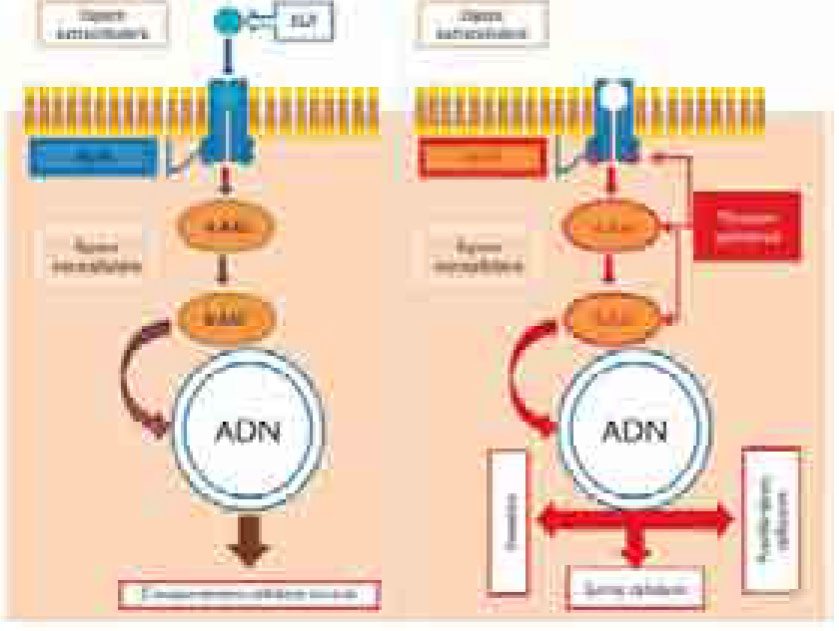 Figure 2 : Voie de signalisation EGFR/KRAS/BRAF et ses mutations cancérigènes
Figure 2 : Voie de signalisation EGFR/KRAS/BRAF et ses mutations cancérigènes


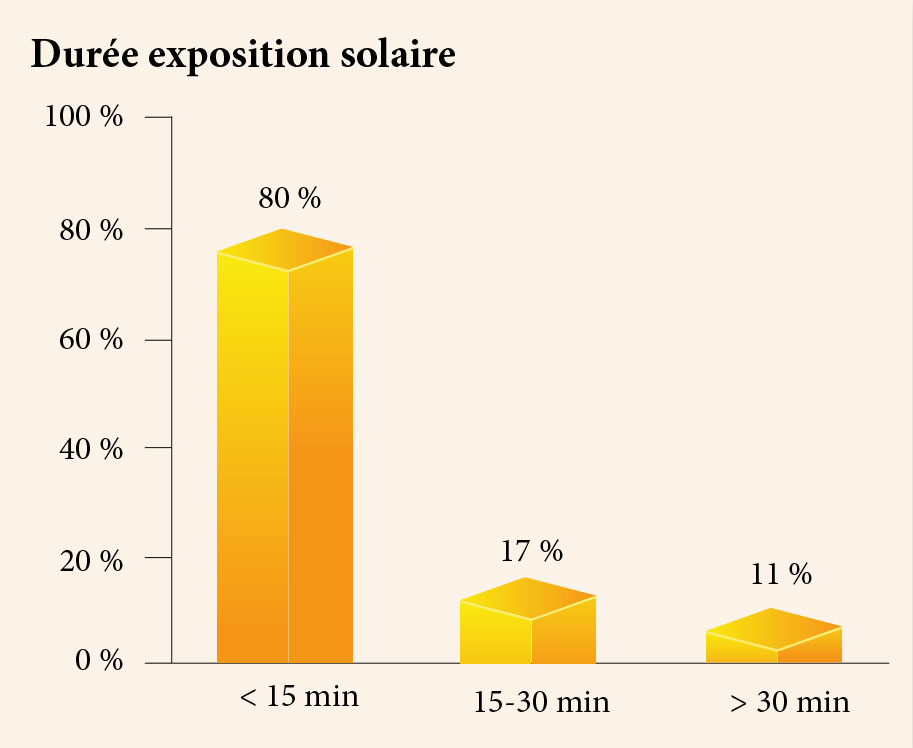
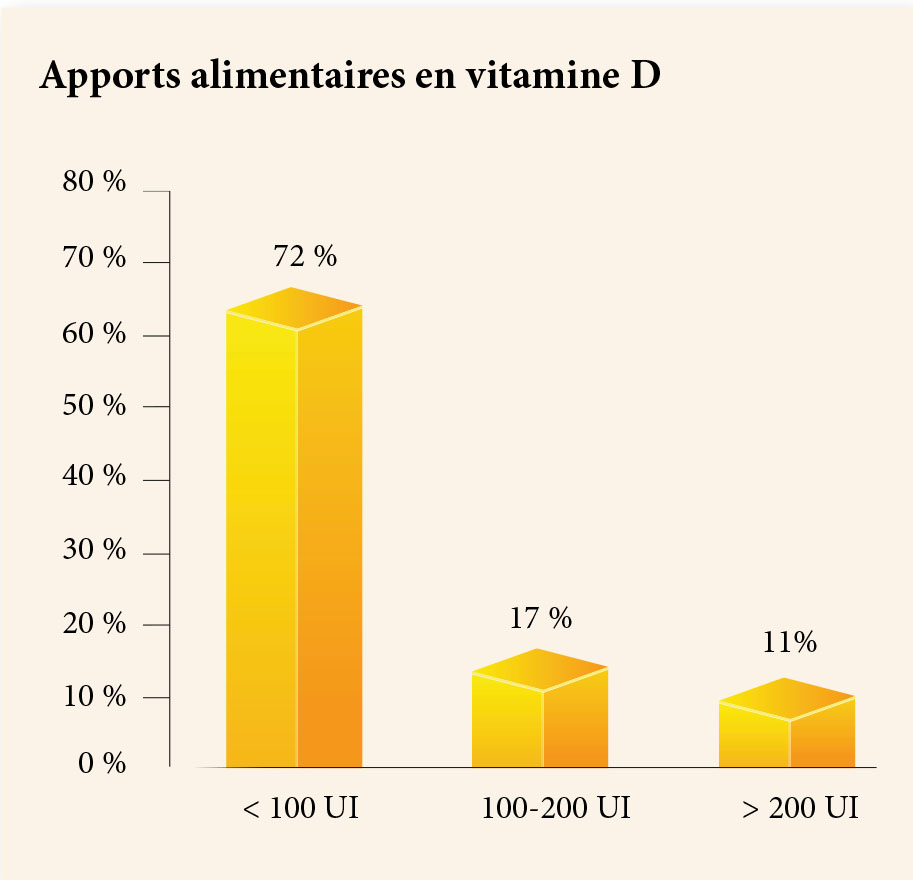
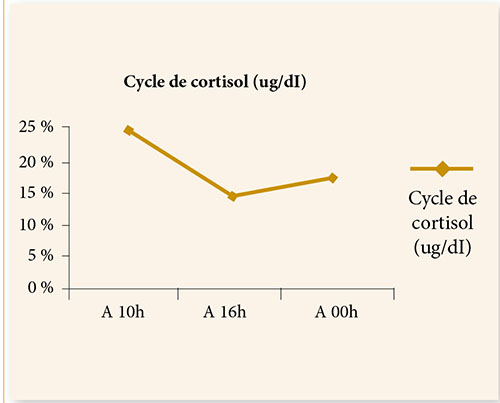
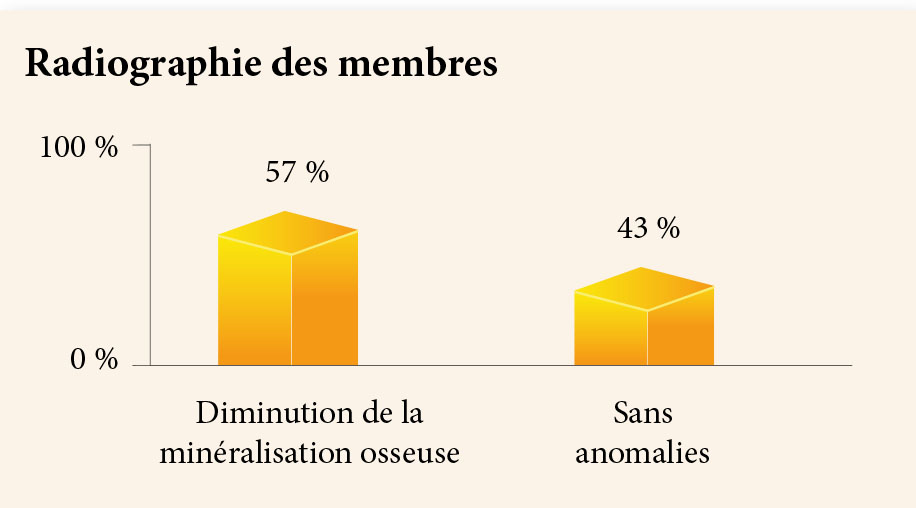 Sur le plan biologique, une calcémie basse (calcémie moyenne : 60 mg/ml) ainsi qu’un taux de PTH augmenté chez 100 % des patientes (moyenne de la PTH=102 pg/ml).
Sur le plan biologique, une calcémie basse (calcémie moyenne : 60 mg/ml) ainsi qu’un taux de PTH augmenté chez 100 % des patientes (moyenne de la PTH=102 pg/ml).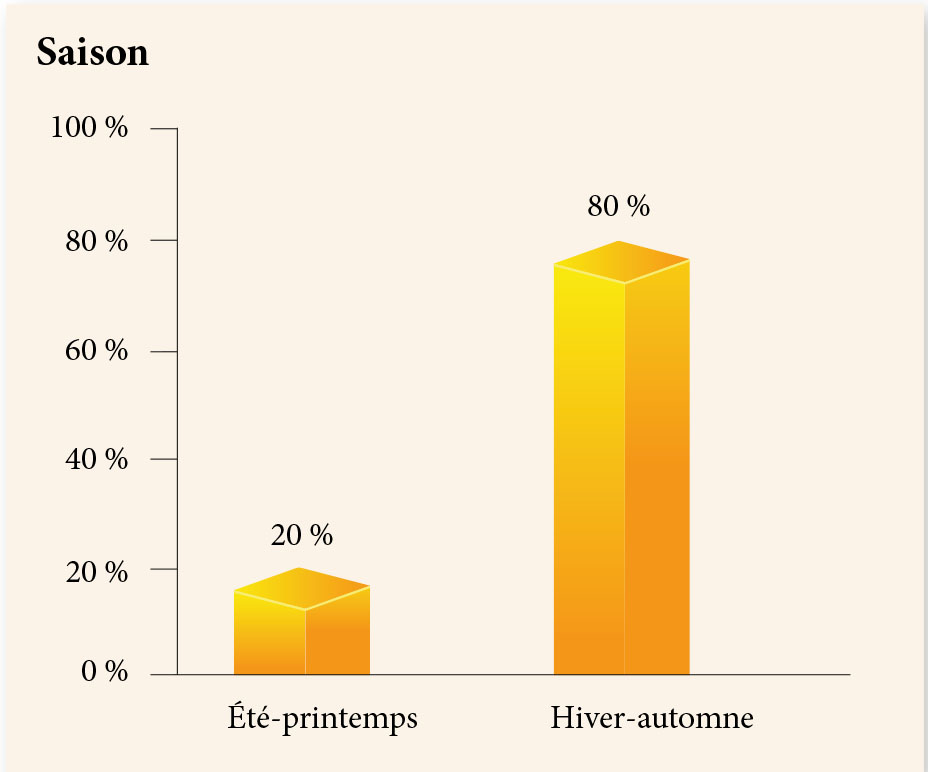


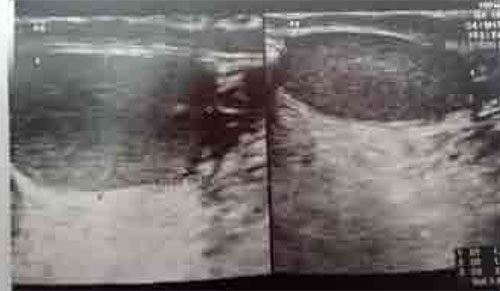
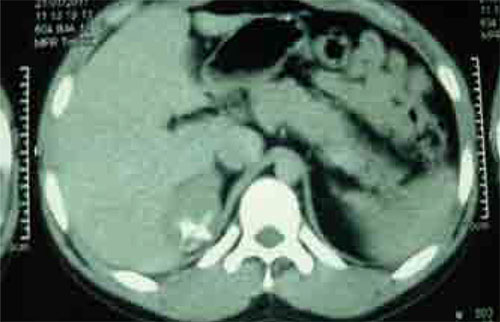
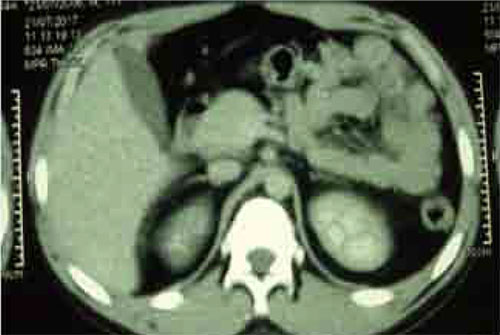
 Aspect morphologique en faveur d’un adénome cortico-surrénalien remanié, sans signes histologiques évidents de malignité, score de Weiss entre 1-2.
Aspect morphologique en faveur d’un adénome cortico-surrénalien remanié, sans signes histologiques évidents de malignité, score de Weiss entre 1-2.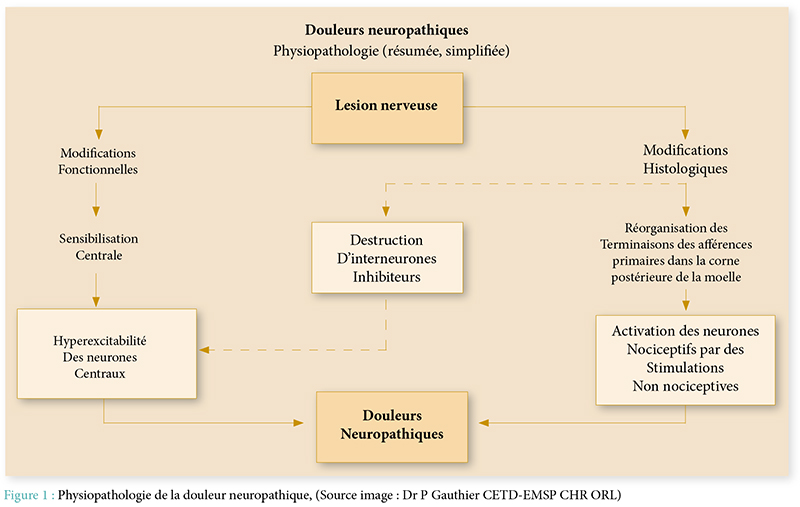
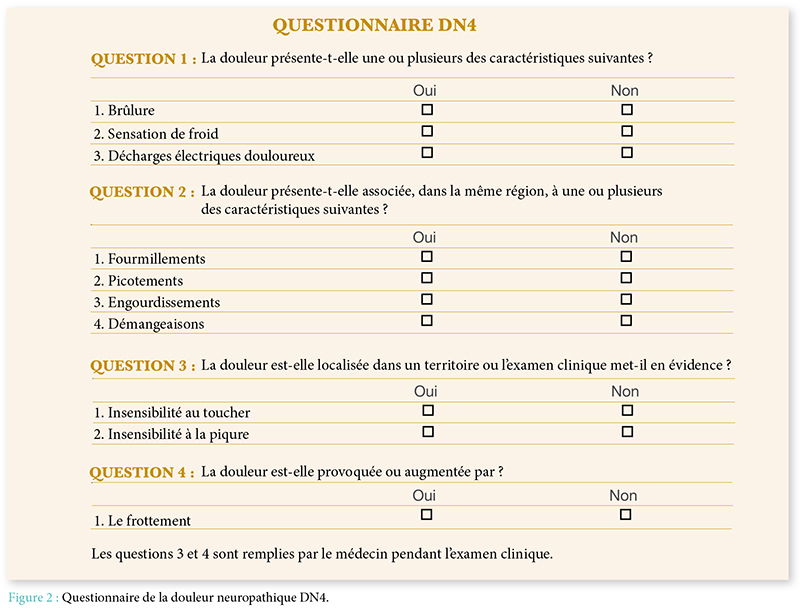
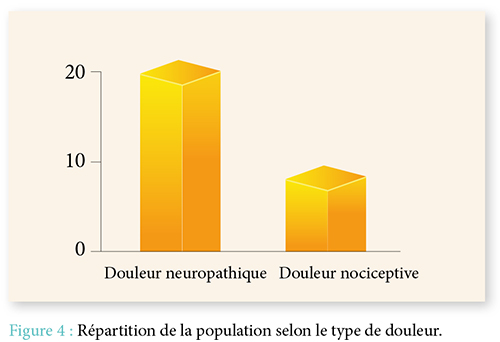
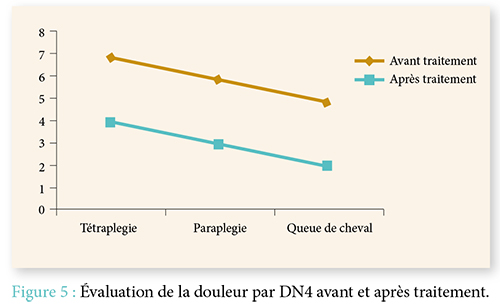
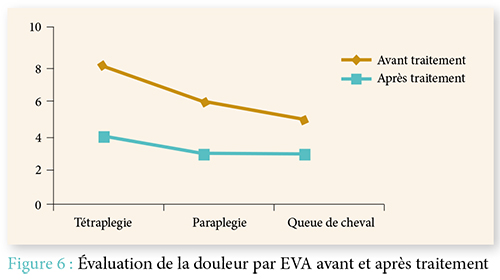

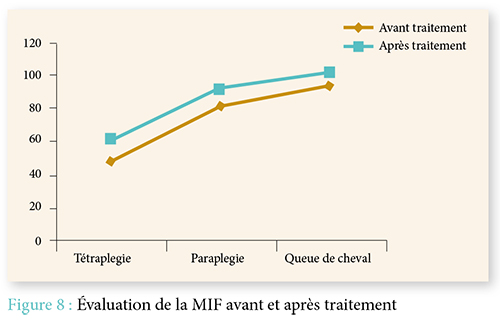 La douleur est un symptôme fréquemment retrouvé chez les patients présentant une paralysie. Notre étude a clairement démontré qu’elle pouvait être d’origine variable ; d’où l’intérêt de faire un bilan complet : étiqueter la douleur, évaluer son intensité, son retentissement moteur, et enfin traiter chaque douleur de façon spécifique.
La douleur est un symptôme fréquemment retrouvé chez les patients présentant une paralysie. Notre étude a clairement démontré qu’elle pouvait être d’origine variable ; d’où l’intérêt de faire un bilan complet : étiqueter la douleur, évaluer son intensité, son retentissement moteur, et enfin traiter chaque douleur de façon spécifique.