Les premières étapes de la prise en charge d’un cancer bronchique sont fondamentales pour le choix du traitement et donc le pronostic du patient.
S. Souilah, Service de Pneumologie CHU Lamine Debaghine, Bab El Oued
Date de soumission : 11 Octobre 2020.
Résumé : Les premières étapes de la prise en charge d’un cancer bronchique sont fondamentales pour le choix du traitement et donc le pronostic du patient. Elles comportent le diagnostic, qui doit être établi avec certitude et précision, le bilan d’extension de la maladie, qui doit être exhaustif, et le bilan fonctionnel pré-thérapeutique. Sur le plan épidémiologique, on note un changement dans les habitudes tabagiques, influençant à la fois l’incidence et le type histologique de cancer observé. Les adénocarcinomes deviennent prévalents aux dépens des carcinomes épidermoïdes. Quelle que soit la symptomatologie clinique, la suspicion de cancer bronchique repose le plus souvent sur la reconnaissance d’un syndrome de masse parenchymateux sur la radiographie thoracique, dont le complément naturel sera la réalisation d’une exploration tomodensitométrique (TDM). Durant les dernières années, la prise en charge diagnostique et pré-thérapeutique du cancer bronchique a évolué avec l’émergence de nouvelles techniques d’exploration endobronchique, de biologie moléculaire permettant une meilleure caractérisation de la tumeur, ainsi que l’utilisation en routine de la tomographie par émission de positons couplée à la TDM (TEP- TDM), permettant un bilan d’extension plus exhaustif. Des recommandations ont été établies concernant le bilan fonctionnel cardiorespiratoire pré-opératoire et une nouvelle édition de la classification TNM est utilisée depuis 2015 (8ème édition). Ces évolutions tendent à mieux caractériser la tumeur et son extension, et à mieux appréhender la tolérance thérapeutique du patient afin de lui proposer le traitement le plus efficace et le mieux adapté.
Mots clés : Cancer bronchique, Diagnostic, bilan d’extension, bilan fonctionnel respiratoire.
Abstract: The first steps in the management of lung cancer are fundamental for the choice of treatment and therefore the patient’s prognosis. They include the diagnosis, which must be established with certainty and precision, the assessment of the spread of the disease, which must be exhaustive, and the functional pre-therapeutic assessment. Epidemiologically, there is a change in smoking habits, influencing both the incidence and the histological type of cancer observed. Adenocarcinomas become prevalent at the expense of squamous cell carcinomas. Whatever the clinical symptomatology, the suspicion of bronchial cancer is most often based on the recognition of a parenchymal mass syndrome on the chest x-ray, the natural complement of which will be the performance of a tomodensitometric (CT) scan. In recent years, the diagnostic and pre-therapeutic management of bronchial cancer has evolved with the emergence of new techniques for endobronchial exploration, molecular biology allowing better characterization of the tumour, as well as the routine use of positron emission tomography coupled with CT (PET-CT) allowing a more exhaustive extension assessment. Recommendations have been established concerning the preoperative cardiorespiratory functional assessment and a new edition of the TNM classification has been used since 2015 (8th edition). These changes tend to better characterize the tumour and its extension, and to better understand the patient’s therapeutic tolerance in order to offer him the most effective and best suited treatment.
Keywords: Lung cancer, diagnostic, assessment of extension, functional respiratory check-up.
1. Introduction
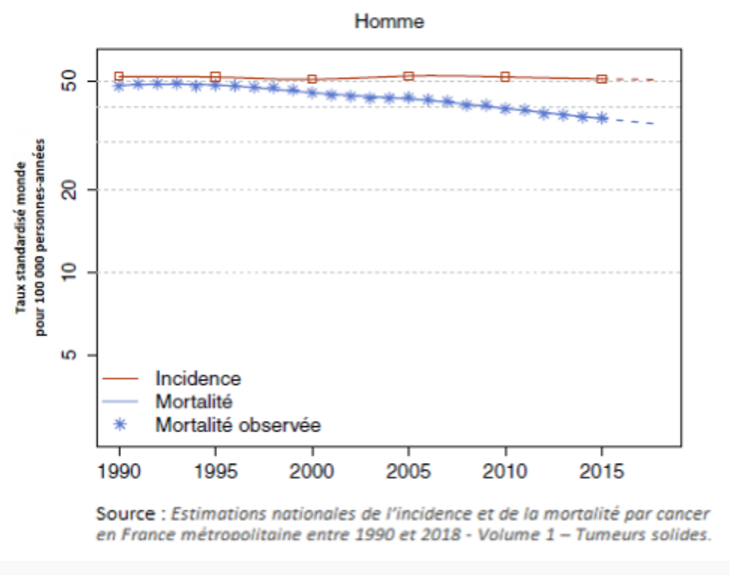
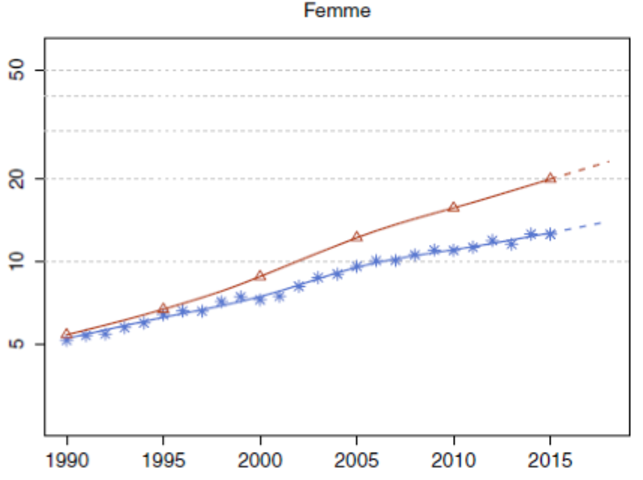
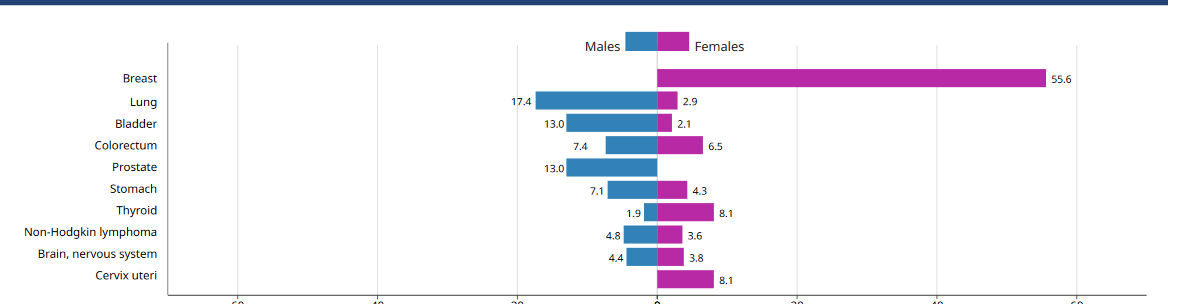
Le cancer bronchique est la cause la plus fréquente de décès par cancer à l’échelle mondiale (Fig. 1) [1]. En Algérie, il reste un problème majeur de santé publique avec plus de 400 nouveaux cas chaque année rien qu’à Alger [2].
La plupart des patients atteints de cancer bronchique sont diagnostiqués tardivement [3]. Ce qui fait qu’une partie de la lutte contre ce cancer passe par un diagnostic le plus précoce possible, imposant de connaître et reconnaître les différentes modalités de présentation de la maladie, et une conduite à tenir diagnostique standardisée et performante afin de réduire le délai de prise en charge [4].
Un diagnostic, établi avec certitude et précision, un bilan d’extension exhaustif de la maladie, et un bilan fonctionnel pré-thérapeutique doivent permettre de proposer au patient le traitement le mieux adapté et le plus conforme aux référentiels des réunions de concertation pluridisciplinaire (RCP).
Figure 1 : incidence et mortalité des cancers de l’homme [1].
2. Présentation clinique
Interrogatoire
Quand suspecter le diagnostic de cancer bronchique ?
Plus de 75% des cancers bronchiques sont diagnostiqués à un stade avancé ou métastatique du fait, d’une part, de l’absence de nocicepteurs dans les bronches ou le poumon et, d’autre part, de l’absence de spécificité des symptômes révélateurs de cancers bronchiques. Par ailleurs, tout signe fonctionnel ou clinique persistant plus de 15 jours chez un fumeur ou ex-fumeur, sans explication patente, doit faire suspecter un cancer bronchique.
Néanmoins, l’existence d’une proportion non négligeable de non-fumeurs parmi les patients atteints de cancer bronchique aujourd’hui doit également pousser à suspecter le diagnostic dans cette population également, sur la base des signes suivants.
Facteurs de risque
Tabagisme
Le facteur de risque principal reste le tabagisme (actif et passif). Il est actuellement responsable d’environ 85% des cancers bronchiques, particulièrement le carcinome épidermoïde et le carcinome à petites cellules. On précisera l’âge de début, la durée, la date de sevrage éventuel. L’intoxication tabagique est mesurée en nombre de paquets années (PA) : un paquet de 20 cigarettes (20 g de tabac) par jour pendant un an correspond à 1 PA.
Consommation de cannabis
Il est indispensable d’inclure à présent la recherche de la consommation de cannabis en même temps que celle du tabac dans l’interrogatoire des patients. « La consultation pour suspicion de cancer du poumon est l’occasion d’évaluer la dépendance aux deux habitudes toxiques et d’encourager le sevrage ». Le cannabis peut être fumé sous forme de “joint” ou inhalé massivement sous forme de “bang”. La quantification se fait en “joint-année” calqué sur le PA : un joint par jour pendant un an correspond à un joint-année.
Cancérigènes d’origine professionnelle
Il ne faut pas se contenter de la dernière profession exercée et il faudra faire préciser l’ensemble du parcours professionnel (Curriculum laboris) et faire décrire les conditions de travail de métiers peu connus qui pourraient être liés à une exposition particulière potentiellement responsable de cancer bronchique (l’amiante, l’arsenic et ses dérivés, le béryllium, le bis-chlorométhyl-éther et le chlorométhyl-méthyl-éther, certains dérivés du cadmium, les dérivés du chrome hexavalent, des hydrocarbures aromatiques polycycliques dérivés du charbon (goudrons de houille, brais et huiles de houille, suies, produits générés au cours de la gazéification du charbon, de la production de coke, dans les fonderies de fonte et d’acier), certains dérivés du nickel, des poussières ou gaz radioactifs (plutonium 239, radon 222 et ses produits de filiation, ce dernier étant rencontré dans des mines de fer), et la silice cristalline.
Une exposition à ces aérocontaminants doit faire envisager le recours aux services de pathologies professionnelles afin d’initier d’éventuelles mesures de reconnaissance.
Signes généraux
Par définition, ces symptômes ne sont pas spécifiques et sont fréquents au diagnostic de tout cancer. Une altération de l’état général isolée (asthénie, anorexie, amaigrissement), doit faire évoquer un cancer. Ces symptômes sont des facteurs pronostiques de la maladie et doivent être recherchés et quantifiés.
Asthénie
L’asthénie correspond à une « fatigue », qu’elle soit physique et/ou psychique. Elle peut être difficile à faire préciser chez les patients dyspnéiques qui ont tendance à confondre les deux symptômes. C’est un paramètre important du performans status (PS) qui évalue l’état général.
Tableau 1 : l’indice de performance de performance de l’OMS
|
PS = 0
|
Pas d’asthénie, activité identique à celle précédant la maladie
|
|
PS = 1
|
Asthénie modérée, n’entrainant pas d’alitement, capable de travailler
|
|
PS = 2
|
Asthénie importante, néanmoins capable de prendre soin de soi, alitement < 50% du temps
|
|
PS = 3
|
Asthénie intense, capable seulement de quelques soins, alitement > 50%
|
|
PS = 4
|
Grabataire, alitement permanent
|
Anorexie
L’anorexie doit être quantifiée et datée afin de séparer les anorexies aiguës (pneumonies) des anorexies chroniques (cancer bronchopulmonaire).
Variations pondérales
Les variations pondérales devront être quantifiées en pesant et mesurant le patient afin de calculer l’indice de masse corporelle ou IMC (dont la norme varie entre 18,5 à 25 chez l’adulte). La cinétique de perte de poids doit être prise en compte (−5 kg sur 12 mois à différencier de −5 kg sur deux mois), tout comme le poids de base (−5 kg chez un patient de 100 kg et −5 kg chez un patient de 50 kg).
Syndrome d’altération de l’état général
Le syndrome d’altération de l’état général associe, dans des proportions variables, asthénie, anorexie et amaigrissement.
Fièvre
La température corporelle normale ne doit pas excéder 37,5° C le matin et 37,8° C l’après-midi. Si la température est prise en axillaire, il faut ajouter +0,9° C au chiffre du thermomètre, si la température est buccale ou rectale, elle est directement interprétable.
Une fièvre, ou une fébricule, peuvent également être présentes au moment du diagnostic, principalement rapportée à une infection bronchopulmonaire ou un syndrome paranéoplasique.
Signes thoraciques
Respiratoires
Les symptômes respiratoires sont souvent présents au diagnostic mais peu spécifiques, et ils inquiètent rarement le patient, d’autant qu’ils sont souvent à tort rapportés au tabagisme.
Tout signe respiratoire non expliqué en particulier chez un fumeur ou un ex-fumeur doit justifier la pratique d’une radiographie thoracique.
Ainsi, la dyspnée est rarement révélatrice, retrouvée essentiellement en cas d’obstruction bronchique proximale, ou elle peut s’accompagner d’un wheezing.
La toux est souvent révélatrice. Une toux d’apparition ou d’aggravation récente, inexpliquée, rebelle au traitement doit alarmer et faire évoquer le diagnostic de cancer bronchique. Pourtant, elle est souvent négligée par les fumeurs dont la toux est habituelle.
Devant toute hémoptysie, même minime, le cancer bronchique doit être évoqué en premier, surtout s’il s’agit d’un patient fumeur. Le plus souvent, les hémoptysies sont répétées, mêlées à une expectoration mucopurulente
Enfin, dans environ un quart des cas, un tableau d’infection respiratoire basse (pneumopathie ou bronchite) est retrouvé. Il s’agit d’infections régressant mal sous antibiotiques, récidivantes (souvent dans le même territoire). Toute pneumopathie chez un patient tabagique doit interroger sur un éventuel facteur favorisant, en particulier la présence d’un cancer bronchique.
Par envahissement locorégional
Des symptômes en rapport avec l’envahissement thoracique locorégional (au médiastin ou à la paroi thoracique) de la tumeur peuvent être observés au diagnostic de cancer bronchique.
Douleurs thoraciques
Les poumons n’ayant pas d’innervation sensitive, les douleurs thoraciques sont liées à des atteintes de la paroi (muscles, os ou articulations), de la plèvre, du cœur et des gros vaisseaux (péricarde, myocarde, aorte), de l’œsophage.
Leur intensité est évaluée à l’aide d’une échelle numérique ou visuelle analogique. Il faut préciser si elles sont responsables de réveils nocturnes ou nécessitent la prise d’antalgiques et leur type (palier 1, 2 ou 3 de l’OMS).
Comme le risque de maladie thromboembolique est plus fréquent en cas de cancer bronchique, devant une douleur thoracique brutale, la recherche d’embolie pulmonaire est systématique.
Par ailleurs, tous les organes du médiastin peuvent être envahis par la tumeur elle-même ou des adénopathies médiastinales.
Ainsi, le cancer bronchique peut être révélé par une dysphonie (en cas d’atteinte du nerf récurrent), une dysphagie (par compression de l’œsophage), un hoquet (par atteinte du diaphragme ou du nerf phrénique), un syndrome cave supérieur (œdème du visage, du cou voire des membres supérieurs, circulation veineuse collatérale, dyspnée, toux), ou une symptomatologie cardiaque ou péricardique (tamponnade, arythmie).
Un cas particulier est le syndrome de Pancoast-Tobias, dû au développement d’une tumeur à l’apex du poumon, envahissant la paroi thoracique, le plexus brachial et le ganglion sympathique stellaire. La tumeur apicale s’accompagne alors d’une lyse costale, d’une névralgie cervico-brachiale C8-D1 et d’un syndrome de Claude-Bernard-Horner (myosis, ptosis, enophtalmie).
Signes extra thoraciques
Métastases
Des métastases sont présentes au diagnostic d’environ 50% des cancers bronchiques. Les sites métastatiques les plus fréquents sont le poumon, la plèvre, les surrénales, le foie, les os et le système nerveux central.
Un grand nombre de symptômes peuvent accompagner ces métastases (douleurs osseuses, signes d’hypertension intracrânienne, céphalée, crise convulsive, troubles moteurs, etc.). Lorsque les symptômes d’une métastase amènent le diagnostic de cancer bronchique, on parle de métastase prévalente.
Syndromes paranéoplasiques
Il s’agit d’un ensemble de symptômes secondaires à l’existence du cancer, indépendants des mécanismes de compression tumorale, dus à la sécrétion par les cellules tumorales d’anticorps, d’hormones ou de peptides agissant à distance de la tumeur.
Ils sont plus fréquents en cas de cancer à petites cellules (10 à 20% des cas). Il peut s’agir de manifestations hormonales (syndrome de Cushing, hypercalcémie, syndrome de sécrétion inappropriée d’hormone antidiurétique), neurologiques (syndrome de Lambert-Eaton, neuropathies), ostéo-articulaires (ostéopathie hypertrophiante pneumique de Pierre-Marie et Foix, hippocratisme digital isolé), cutanéo-musculaires (érythème, dermatomyosite) ou biologiques (syndrome néphrotique, hyperleucocytose, thrombopénie, coagulopathies).
Examen physique
Appréciation de l’état général (PS) et recherche de signes cliniques en faveur d’une extension loco-régionale, d’adénopathies sus-claviculaires et périphériques, de métastases à distance.
Inspection
Un syndrome cave supérieur
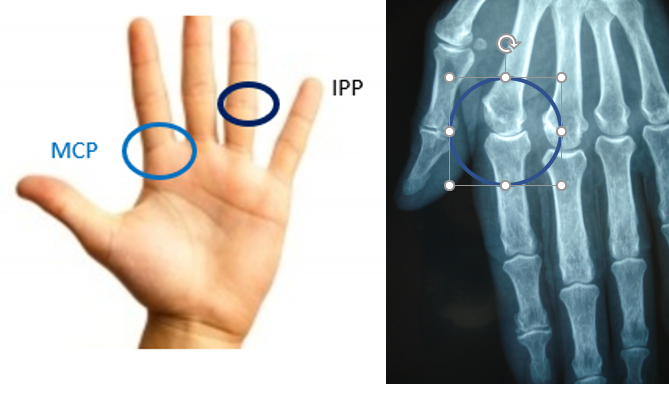
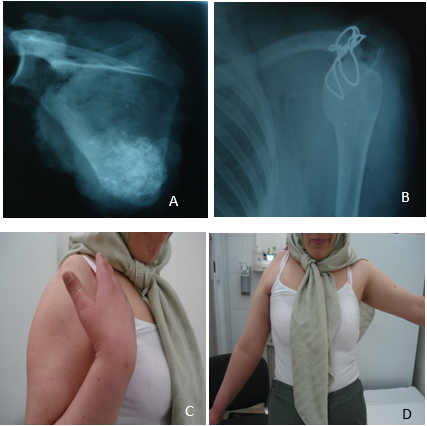
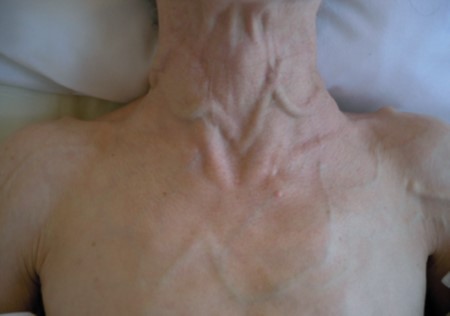
Le syndrome cave supérieur associe une circulation veineuse collatérale, un œdème en « pèlerine » (bilatéral), un œdème du cou et de la face, des paupières gonflées au réveil et un aspect cyanosé des lèvres, en général associé à une turgescence jugulaire (Fig. 2. A).
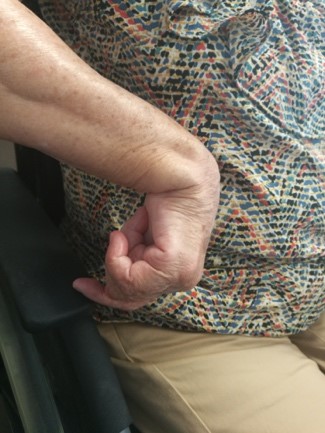
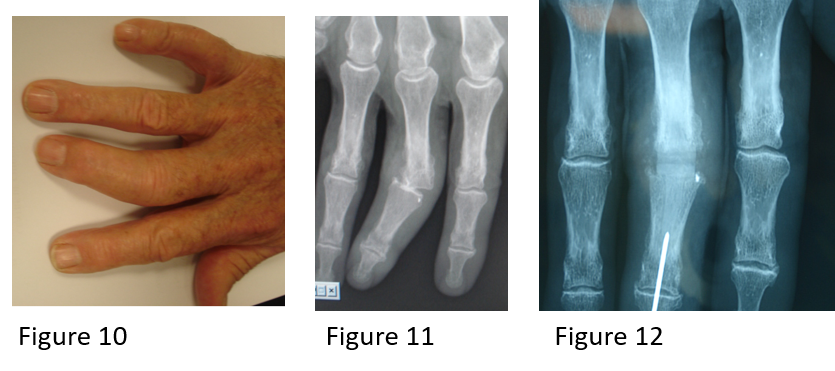
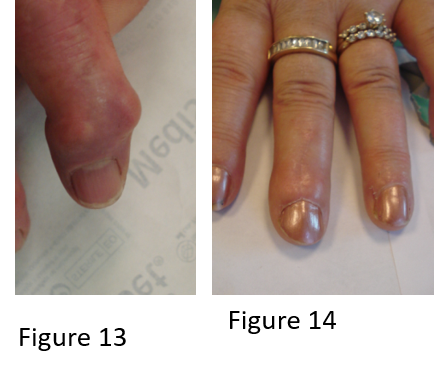
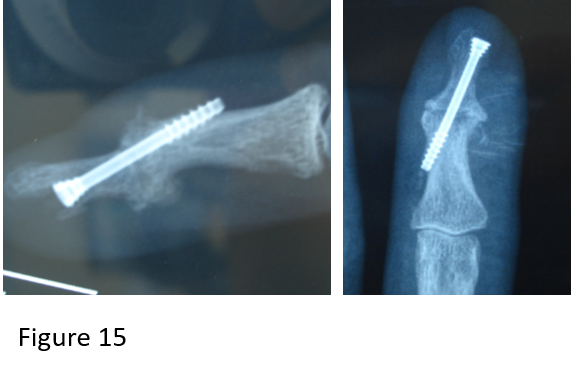
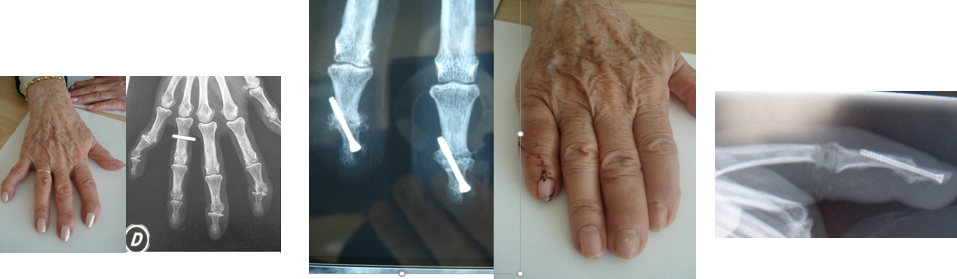
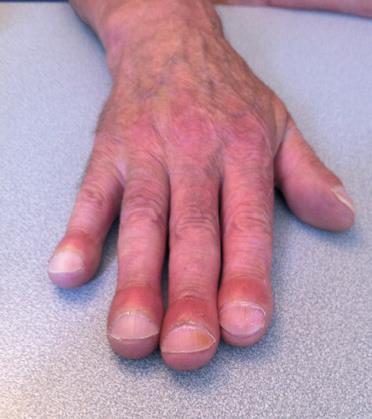
Hippocratisme digital
L’hippocratisme digital est l’élargissement des extrémités des doigts (et des orteils) avec bombements des ongles « en verre de montre », donnant aux doigts un aspect en « baguettes de tambour » (Fig .2. B).
Il peut être isolé ou faire partie de l’ostéopathie hypertrophiante pneumique (de Pierre-Marie), s’accompagnant alors d’arthralgies, de douleurs au niveau de la diaphyse des os longs avec appositions périostées radiologiques (syndrome paranéoplasique du cancer bronchique).
 |
 |
|
A : Circulation veineuse collatérale thoracique et turgescence jugulaire externe bilatérale
|
B : Hippocratisme digital
|
|
Figure 2 : syndrome cave supérieur et hippocratisme digital [5].
|
Palpation
La palpation permet enfin de rechercher des points douloureux, d’explorer les aires ganglionnaires, de rechercher une tuméfaction mammaire, sous-cutanée ou osseuse.
Certains tableaux cliniques nécessitent une prise en charge en urgence ou semi-urgence (syndrome cave supérieur, douleurs importantes ou hémoptysie selon son abondance, maladie thromboembolique, pleurésie abondante, stridor, hypertension intracrânienne).
3. Présentation radiologique
Quelle que soit la symptomatologie clinique, la suspicion de cancer bronchopulmonaire repose le plus souvent sur la reconnaissance d’un syndrome de masse parenchymateux sur la radiographie thoracique, dont le complément naturel sera la réalisation d’une tomodensitométrie thoracique. La difficulté diagnostique essentielle concerne le problème du nodule pulmonaire solitaire. La tomodensitométrie peut apporter des éléments complémentaires et participer au diagnostic histologique en permettant le guidage d’une éventuelle ponction biopsie [6].
Radiographie thoracique
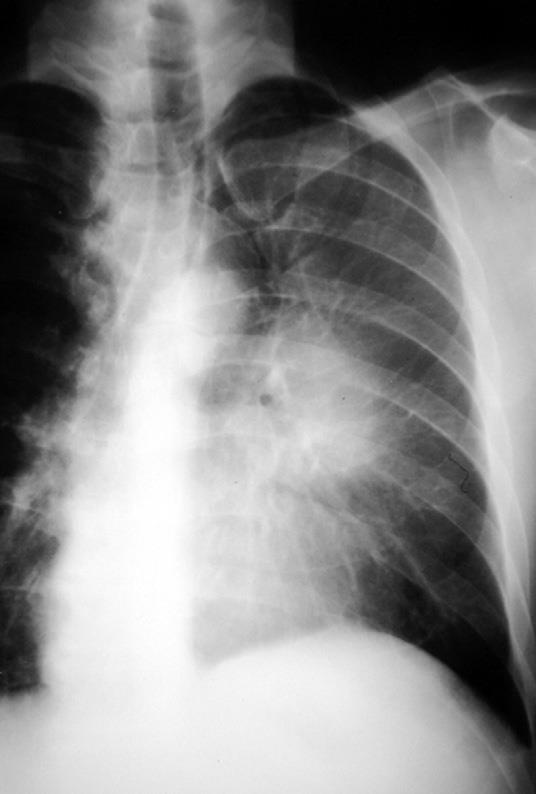
Les signes radiologiques dépendent du siège central ou périphérique de la tumeur.
Tumeurs centrales
La tumeur centrale se développe en endobronchique et/ou en transbronchique. Lorsque la croissance s’effectue essentiellement en endobronchique, la conséquence directe est la sténose avec troubles ventilatoires d’aval (Fig. 3. A). Leur expression radiologique est variable : piégeage, collapsus aéré ou non, pneumopathie obstructive.
Dans le cas d’un développement transbronchique de la tumeur, la lésion apparaît comme une masse hilaire isolée ou associée à un trouble de ventilation. S’il existe un collapsus non aéré d’aval, la tumeur peut être noyée dans l’opacité et non reconnue. Ces masses tumorales proximales peuvent être associées à des adénopathies de la région hilaire. Dans ce cas, il est difficile de différencier tumeur et adénopathies, et l’on parle de complexe gangliotumoral.
Il faut savoir qu’une radiographie thoracique normale n’élimine pas la possibilité de cancer bronchique.
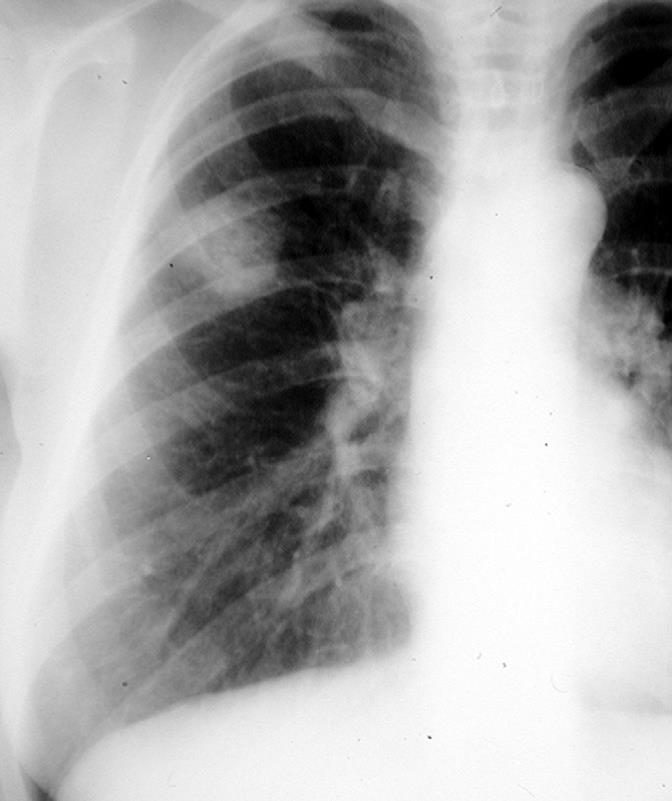
Tumeurs périphériques
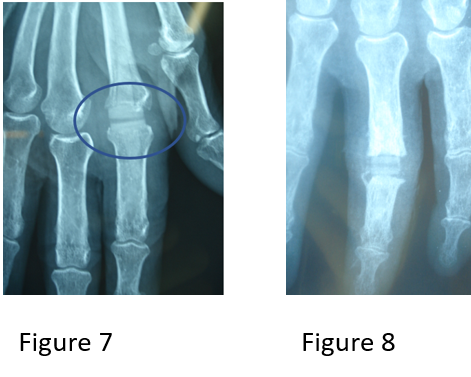
La plupart de ces tumeurs périphériques se traduisent par l’existence d’une masse arrondie à contours réguliers (Fig. 3. B), lobulés ou irréguliers, de plage homogène ou non avec parfois une excavation centrale.
La radiographie thoracique ne permet de voir que les lésions évidentes, les pleurésies, ou les lyses costales et doit toujours être complétée en cas d’anomalie par un scanner thoracique.
 |
 |
|
A Diminution de transparence de l’hémi- champ pulmonaire gauche paratélectasie lobaire supérieure secondaire à un syndrome de masse de larégionla région hilaire
|
B Opacité nodulaire lobaire supérieure droite.
|
|
Figure 3 : radiographie thoracique de face[7].
|
Tomodensitométrie
Un scanner thoracique avec injection doit être réalisé devant toute suspicion de cancer bronchique, sauf contre-indication.
Une première hélice sans injection sur les surrénales est recommandée afin de caractériser plus facilement un éventuel nodule surrénalien. Idéalement, l’hélice injectée couvre également l’abdomen (foie et surrénales), et les aires sus-claviculaires (potentiels ganglions classant le malade N3). L’injection doit permettre d’opacifier de façon satisfaisante les vaisseaux médiastinaux, afin d’analyser de façon précise leurs rapports avec la tumeur lorsque celle-ci est développée au contact du médiastin, et de mieux visualiser les hiles et les éventuelles adénopathies.
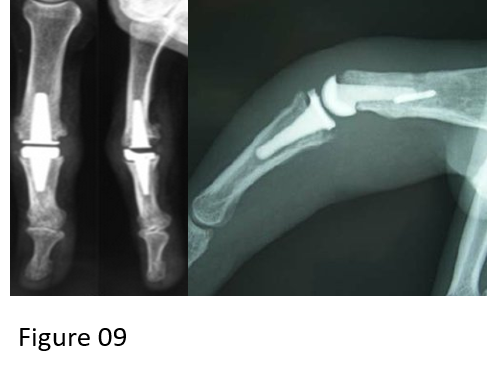
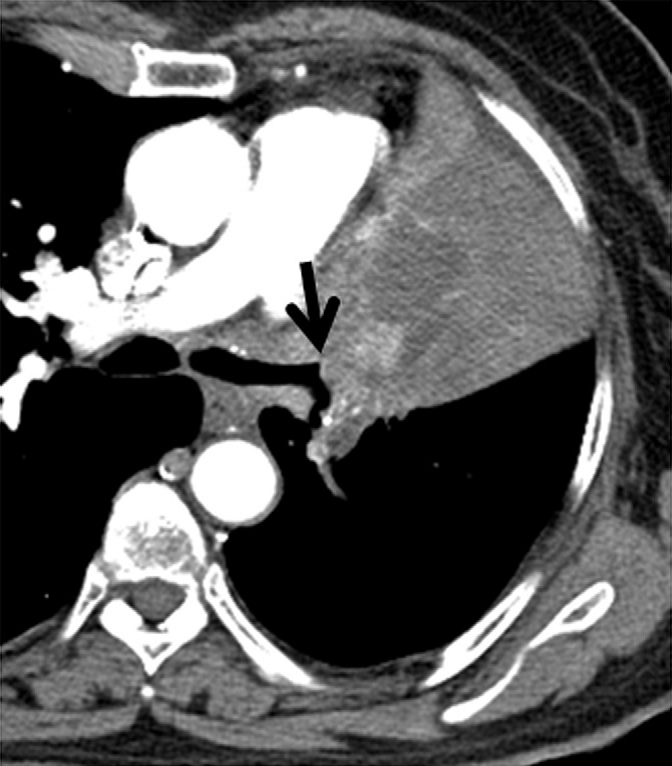
Elle permet également de différencier la tumeur d’un éventuel collapsus associé et de visualiser des zones de nécrose tumorale (Fig. 4). En cas d’épanchement pleural, une pré-imprégnation peut être intéressante pour détecter des signes d’atteinte spécifique.
Il s’agit d’injecter une partie du produit de contraste (généralement un tiers de la quantité totale) au patient, et d’attendre 2 à 3 minutes avant d’injecter la deuxième partie et de lancer l’hélice. Cette pré-imprégnation est intéressante pour l’étude de la pathologie pleurale en général, et notamment pour le bilan d’épanchements pleuraux récidivants.
La TDM thoracique apportera des précisions sur la lésion primitive, sa topographie, sa localisation hilaire centrale ou périphérique, son caractère systématisé, rétractile ou non rétractile, ses rapports avec les structures avoisinantes de la paroi thoracique, de la plèvre ou du médiastin (Fig. 4) [8].
La TDM thoracique devra idéalement être faite avant les examens à visée diagnostique dont il améliore la précision diagnostique [8,9].
 |
Sténose de la bronche lobaire supérieure gauche (flèche) avec atélectasie d’aval et mauvaise différenciation entre tumeur et trouble ventilatoire.
|
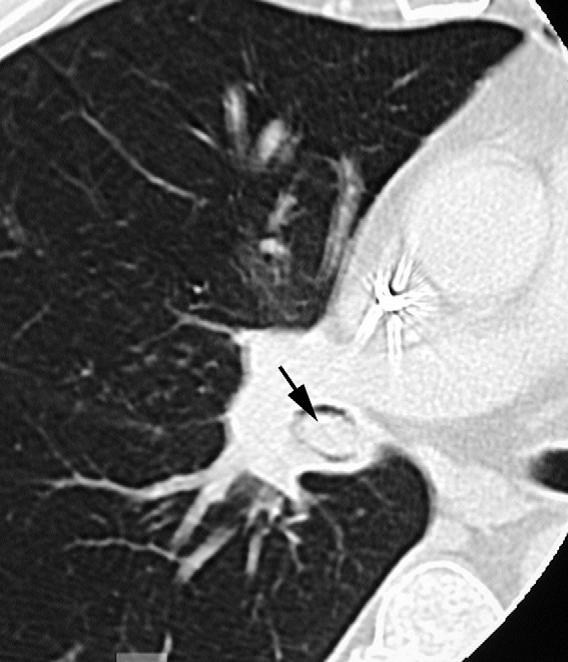 |
Syndrome tumoral à développement endoluminal au niveau du tronc bronchique intermédiaire (flèche).
|
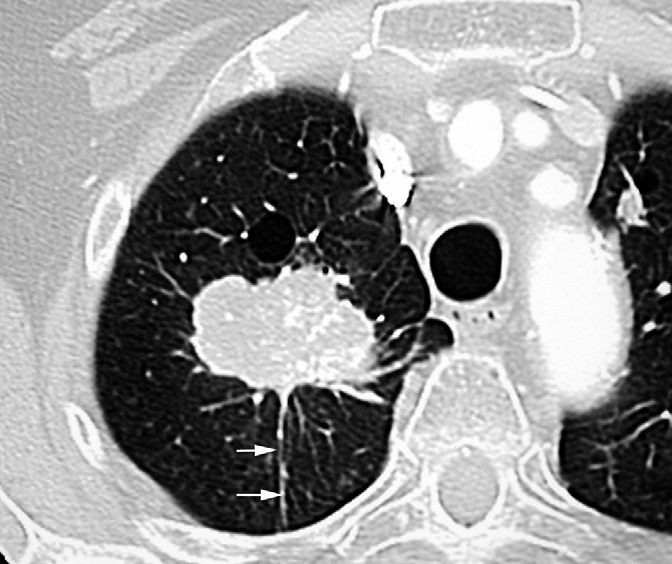 |
Syndrome tumoral apical droit à contours lobulés et irréguliers spiculaires associés à des prolongements linéaires vers la plèvre.
|
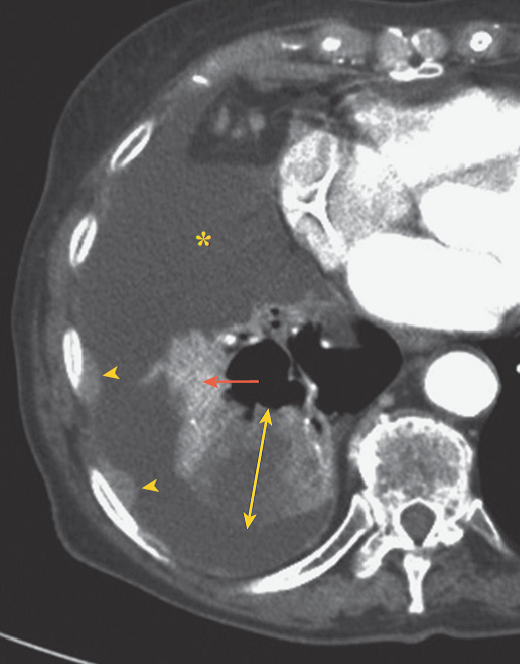 |
Coupe axiale en fenêtre médiastinale après injection de produit de contraste iodé et pré imprégnation pleurale. L’injection de produit de contraste permet de différencier la tumeur (double flèche jaune) du collapsus (flèche rouge)et de l’épanchement pleural (astérisque) associés. Elle permet également de visualiser l’épaississement nodulaire de la plèvre (têtes de flèches), très suspect d’atteinte pleurale métastatique (M1a)
|
Figure 4 : Coupe TDM avec injection de produit de contraste [7].
TEP- TDM
La TEP- TDM s’avère également une méthode très intéressante pour le diagnostic positif de malignité d’un syndrome de masse bronchopulmonaire. En effet, les tumeurs malignes bronchopulmonaires présentent une augmentation du métabolisme du glucose liée, d’une part à l’augmentation du nombre des protéines de transport du glucose, et d’autre part, à une élévation du taux intracellulaire d’enzymes (hexokinase et phosphofructokinase) qui vont amorcer la glycolyse [10]. Mais si la TEP-TDM est intéressante pour préciser le caractère malin ou bénin d’une lésion parenchymateuse pulmonaire, elle est surtout utile dans la conduite à tenir devant la découverte d’un nodule pulmonaire du fait d’une valeur prédictive négative élevée [11,12].
Elle contribue à différencier les nodules bénins des nodules malins avec des performances supérieures aux techniques d’imagerie conventionnelle [13, 14]. Elle permet dès lors de diminuer la fréquence des actes techniques invasifs, et de la thoracotomie lors de la prise en charge d’un nodule pulmonaire isolé.
4. Examens à visée diagnostique
Le diagnostic du cancer bronchique est histologique et le choix de la technique de prélèvement pour réaliser cet examen dépend de la localisation de la maladie (déterminée par l’examen clinique et l’imagerie), de l’état général du patient et de ses comorbidités.
L’examen anatomopathologique peut être fait sur des prélèvements tissulaires (biopsies), ou à défaut, cytologiques (lavage, brossage, ponction aspiration) de la tumeur [15]. L’analyse des adénopathies ou d’un site métastatique accessible peut également être réalisée.
La bronchoscopie souple
C’est la technique de référence pour confirmer le diagnostic lorsque la tumeur siège au niveau de l’arbre bronchique principal.
En cas de tumeurs centrales endo-bronchiques, les prélèvements biopsiques devront intéresser la tumeur elle-même, la base d’implantation, et en pleine tumeur, les éperons voisins et la carène si nécessaire. L’étude cytologique du produit d’aspiration réalisée dans de bonnes conditions, peut aider au diagnostic. Il est recommandé de réaliser 5 biopsies pour le diagnostic et 5 biopsies supplémentaires pour phénotypage et génotypage [16], accompagnées d’un brossage, d’un lavage et d’une aspiration de manière à obtenir une rentabilité estimée à près de 80%. La fixation des prélèvements histologiques doit utiliser le formol.
Dans le cas d’une tumeur centrale sous-muqueuse ou péri-bronchique, la cytoponction trans-bronchique permet de réaliser de manière peu invasive un diagnostic et/ou un staging, avec un rendement diagnostique moyen de 70% [17]. La rentabilité diagnostique de la cytoponction trans-bronchique augmente jusqu’à 98% selon les études, quand elle est réalisée en écho-endoscopie.
Les développements récents, liés à l’apport de l’échographie endoscopique et au guidage par navigation électromagnétique ont permis l’exploration diagnostique des lésions périphériques, ainsi que l’évaluation du médiastin, limitant les procédures invasives, telles que la médiastinoscopie et la vidéothoracoscopie [18].
Ces progrès positionnent l’expert de l’endoscopie sur un pied d’égalité avec le radiologue pour l’évaluation de la lésion pulmonaire périphérique ou du chirurgien pour l’exploration médiastinale.
La ponction-biopsie par voie transpariétale
En cas de négativité de la bronchoscopie souple et de lésion accessible, une ponction-biopsie transpariétale réalisée sous anesthésie locale peut être proposée, guidée par scanner ou exceptionnellement par échographie en cas d’envahissement pariétal. Cet examen présente une sensibilité de 90% et une spécificité de 97%. Il est recommandé de réaliser 1 à 2 carottes, en gauge 18 et en coaxial.
Techniques chirurgicales
La vidéothoracoscopie et la thoracotomie doivent être limitées au cas où les techniques moins invasives n’ont pu être réalisées ou n’ont pas permis de confirmer le diagnostic. Chez un patient opérable, la thoracotomie peut permettre un geste à la fois diagnostique et thérapeutique si l’examen anatomopathologique extemporané conclut à la malignité.
Autres prélèvements
Les lésions suspectes, pleurale, ganglionnaire ou à distance, permettront un prélèvement qui aidera à poser le diagnostic et à préciser l’extension locorégionale ou métastatique.
5. Annonce du diagnostic
Toute démarche clinique ayant abouti à un diagnostic de certitude de cancer bronchique doit obligatoirement être suivie par une annonce du diagnostic de la maladie au patient et à sa famille.
L’annonce diagnostique devra se faire dans des conditions optimales, avec un temps de consultation dédiée et des ressources adéquates (psycho-oncologue, infirmière, etc.). Le lien avec la médecine de ville sera renforcé. L’annonce portera sur le diagnostic mais aussi le plan personnalisé de soins et les mesures associées (déclaration de maladie professionnelle, préservation de la fertilité si applicable, etc.)
6. Bilan pré-thérapeutique
La chirurgie constitue la thérapeutique la plus efficace du cancer bronchique non à petites cellules. Il est donc nécessaire de réaliser une sélection rigoureuse des patients candidats à la chirurgie, et cette sélection ne peut se faire qu’en réalisant un bilan d’extension locorégional et général aussi précis que possible.
Le bilan pré-thérapeutique doit être réalisé dans des délais les plus courts possibles et dépend évidemment de l’accessibilité aux examens et de l’état physiologique du patient [19].
Bilan d’extension
La prise en charge thérapeutique du cancer bronchique dépend du stade de la maladie, et de l’état physiologique et fonctionnel du patient. Le bilan d’extension est donc une étape primordiale, car il permet de déterminer le stade de la maladie par l’établissement de sa classification TNM.
De l’exhaustivité de ce bilan va dépendre la justesse de la décision, il doit être réalisé le plus rapidement possible. En cas de non disponibilité de la TEP-TDM les anciennes recommandations restent valables.
Les patients sont alors répartis en deux groupes au pronostic distinct : ceux dont la maladie est localisée (stade I, II ou III), qui peuvent bénéficier d’un traitement locorégional, et ceux découverts d’emblée au stade métastatique (stade IV), dont la survie globale est beaucoup plus sombre.
Au moment de la présentation du dossier à la RCP pour une décision thérapeutique, l’ancienneté de la date de réalisation du bilan pré-thérapeutique ne doit pas excéder 6 semaines.
Ce bilan d’extension est réalisé aujourd’hui selon la nouvelle classification de l’IASLC (8eédition) [20].
Tableau 2 : Classification TNM (8e édition)[20].
|
Stade
|
TNM
|
Description
|
|
T = tumeur primaire (taille tumorale de la plus grande dimension) ; N = ganglion régional ; M = métastase à distance.
|
|
Carcinome occulte
|
TX, N0, M0
|
TX = Tumeur primaire non connue ou tumeur prouvée par la présence de cellules malignes dans les sécrétions broncho-pulmonaires mais non visible aux examens radiologiques et endoscopiques
N0 = Aucune métastase ganglionnaire régionale.
M0 = Aucune métastase à distance.
|
|
0
|
Tis, N0, M0
|
Tis= carcinome in situ : SCIS= carcinome épidermoïde in situ ; AIS= adénocarcinome in situ (Adénocarcinome lipidique pur ≤3 cm dans la plus grande dimension) N0.M0
|
|
IA1
|
T1a(mi), N0, M0
T1a, N0, M0
|
T1 = Tumeur ≤3 cm, entourée par du poumon ou de la plèvre viscérale, sans évidence d’invasion plus proximale que les bronches lobaires à la bronchoscopie (c’est-à-dire pas dans les bronches souches).
T1a(mi) = Adénocarcinome minimalement-invasif : adénocarcinome (≤3 cm dans la plus grande dimension) principalement lipidique et une invasion ≤5 mm.N0.M0
T1a = Tumeur ≤1 cm. N0. M0
|
|
IA2
|
T1b, N0, M0
|
T1b = Tumeur> 1 cm mais ≤2 cm N0. M0
|
|
IA3
|
T1c, N0, M0
|
T1c = Tumeur> 2 cm mais ≤3 cm N0. M0
|
|
IB
|
T2a, N0, M0
|
T2 = Tumeur de plus de 3 cm, mais de moins de 5 cm OU avec un quelconque des éléments suivants
· Envahissement d’une bronche souche quelle que soit sa distance par rapport à la carène mais sans envahissement de la carène,
· Envahissement de la plèvre viscérale,
· Existence d’une atélectasie ou pneumonie obstructive
T2a = Tumeur> 3 cm mais ≤4 cm.N0.M0
|
|
IIB
|
T1a, N1, M0
|
T1a. N1 = Métastases ganglionnaires péri-bronchiques homolatérales et/ou hilaires homolatérales incluant une extension directe. M0
|
|
T1b, N1, M0
|
T1b.N1.M0
|
|
T1c, N1, M0
|
T1c. N1.M0
|
|
T2a, N1, M0
|
T2a. N1. M0
|
|
T2b, N1, M0
|
T2b = Tumeur> 4 cm mais ≤5 cm. N1. M0
|
|
T3, N0, M0
|
T3 = tumeur> 5 cm mais ≤ 7 cm ou envahissant directement l’un des éléments suivants : plèvre pariétale, paroi thoracique (y compris les tumeurs du sommet), nerf phrénique, péricarde pariétal ; ou des nodules tumoraux séparés dans le même lobe que le primaire
N0. M0
|
|
IIIA
|
T1a, N2, M0
|
T1a. N2= Métastases dans les ganglions médiastinaux homolatéraux et/ou dans les ganglions sous-carénaires. M0
|
|
T1b, N2, M0
|
T1b. N2. M0
|
|
T1c, N2, M0
|
T1c. N2. M0
|
|
T2a, N2, M0
|
T2a. N2. M0
|
|
T2b, N2, M0
|
T2b. N2. M0
|
|
T3, N1, M0
|
T3. N1. M0
|
|
T4, N0, M0
|
T4 = tumeur> 7 cm ou tumeur de toute taille envahissant un ou plusieurs des éléments suivants : diaphragme, médiastin, cœur, gros vaisseaux, trachée, carène, nerf récurrent, œsophage, corps vertébral ; ou associée à des nodules tumoraux séparés dans un lobe ipsilatéral différent de celui du lobe de la tumeur primaire. N0. M0
|
|
T4, N1, M0
|
T4. N1. M0
|
|
IIIB
|
T1a, N3, M0
|
T1a. N3 = Métastases ganglionnaires médiastinales controlatérales ou hilaires controlatérales ou scaléniques, sus-claviculaires homo-ou controlatérales. M0
|
|
T1b, N3, M0
|
T1b. N3. M0
|
|
T1c, N3, M0
|
T1c. N3. M0
|
|
T2a, N3, M0
|
T2a. N3.M0
|
|
T2b, N3, M0
|
T2b. N3. M0
|
|
T3, N2, M0
|
T3. N2. M0
|
|
T4, N2, M0
|
T4. N2. M0
|
|
IIIC
|
T3, N3, M0
|
T3. N3. M0
|
|
T4, N3, M0
|
T4. N3. M0
|
|
IV
|
IVA
Tout T, Tout N, M1a
Tout T, Tout N, M1b
|
Tout T, Tout N
M1a = Nodule (s) tumoral (aux) séparés dans un lobe controlatéral, ou nodules pleuraux ou pleurésie maligne ou péricardite maligne
M1b = Une seule métastase extra-thoracique dans un seul organe
|
|
IVB
Tout T, Tout N, M1c
|
M1c = Plusieurs métastases extra-thoraciques dans un seul ou plusieurs organes
|
A. Tumeur potentiellement accessible à un traitement locorégional
La classification TNM comprend une évaluation du statut tumoral (T), ganglionnaire (N) et métastatique (M)
Évaluation du statut tumoral (T)
- TDM thoracique avec injection de produit de contraste
- Bronchoscopie souple avec biopsies des éperons adjacents
- IRM thoracique si tumeur de l’apex, suspicion d’atteinte vertébrale, médullaire, vasculaire (artère sous-clavière)
- Échographie cardiaque endo-œsophagienne si doute sur une atteinte atriale
Évaluation du statut ganglionnaire (N)
- TEP-TDM ou TDM thoracique si TEP non disponible
- Confirmation histo-cytologique en cas d’hypermétabolisme ganglionnaire médiastinal à la TEP-TDM ou de ganglions médiastinaux> 15 mm à la TDM
- Examen de référence : médiastinoscopie cervicale
- Alternative : technique mini-invasive (ponction-biopsie transbronchique avec ou sans échoguidage, transoesophagienne échoguidée ou transthoracique) – médiastinoscopie indiquée si examen non contributif.
Évaluation du statut métastatique (M)
- Examen clinique minutieux
- Imagerie cérébrale systématique (TDM avec injection de produit de contraste si pas de contre-indication ou IRM)
- TEP-TDM si non disponible (TDM abdominale ou échographie abdominale + scintigraphie osseuse)
- Les zones fixantes à la scintigraphie doivent être explorées par des examens radiologiques appropriés.
- En cas d’épanchement pleural, la ponction pleurale pour examen cytologique est recommandée : si cet examen est non contributif, une biopsie pleurale doit être faite (à l’aiguille et si négative thoracoscopie)
- La recherche de la preuve histologique d’une lésion métastatique n’est justifiée que si celle-ci est unique et si cela peut modifier la stratégie thérapeutique.
- Confirmation anatomopathologique de toute métastase susceptible de modifier le traitement
B. Tumeur non accessible à un traitement locorégional
- TEP-TDM non indiquée
- En présence de signes d’appel, des examens complémentaires sont discutés selon la localisation suspectée et l’incidence thérapeutique attendue.
Bilan fonctionnel
Le bilan fonctionnel avant résection pulmonaire pour CBNPC a pour but de détecter les patients à risque de complications cardio-respiratoires per-opératoires. Il doit estimer le risque opératoire de la résection pulmonaire envisagée, identifier des actions ciblées pouvant diminuer ce risque ou en l’absence de telles actions, orienter vers des techniques chirurgicales moins invasives, voire vers des thérapies palliatives.
Évaluation clinique
Doit se faire chez un patient au mieux de sa forme, après arrêt du tabagisme et traitement des pathologies associées. Elle se focalisera sur les sphères respiratoire et cardio-vasculaire.
Bilan respiratoire préopératoire
Pour l’évaluation de la fonction respiratoire, la mesure du VEMS est indiquée en première intention. Selon les résultats du VEMS une démarche pouvant être divisée en trois étapes est recommandée (Fig 5).
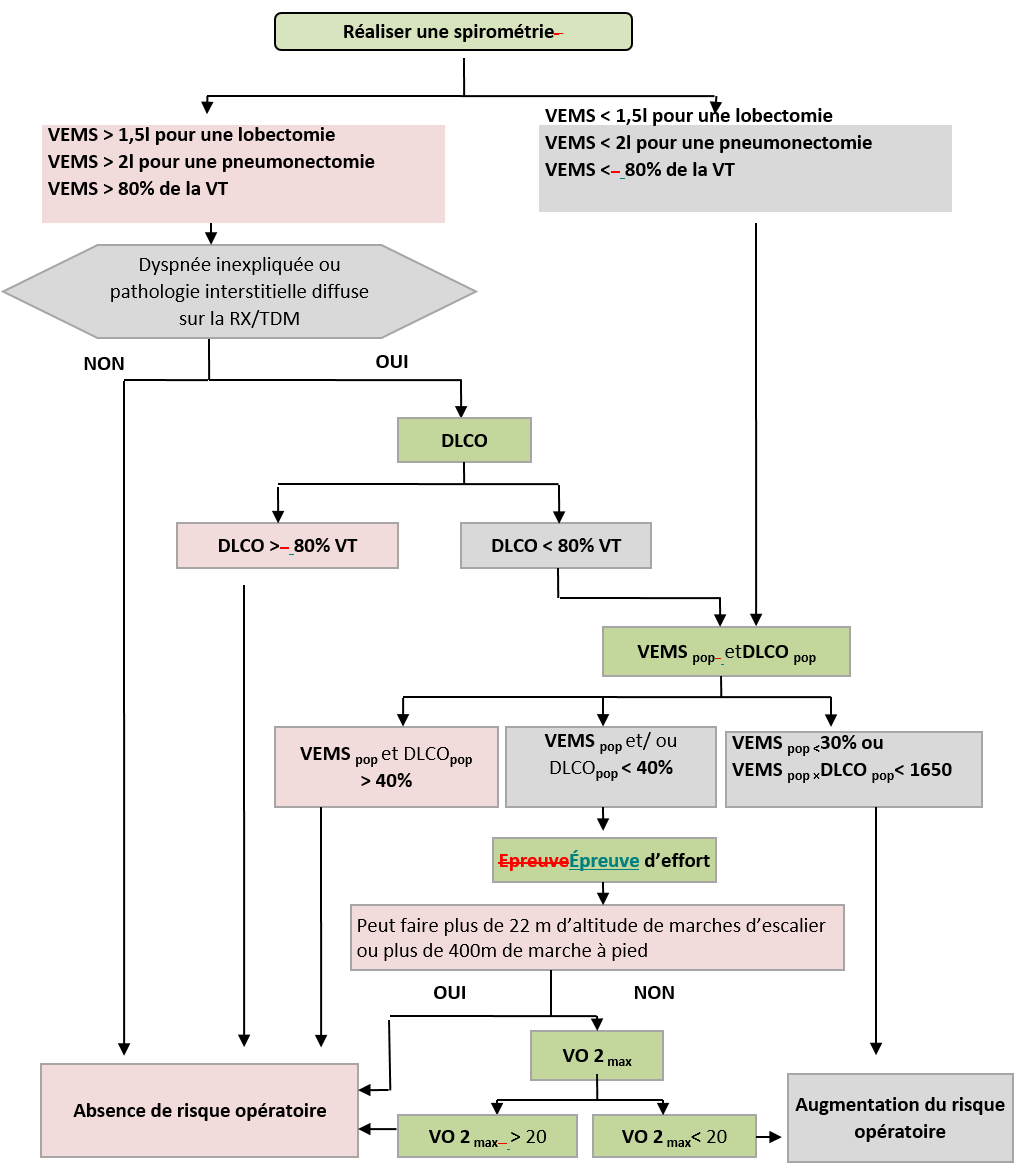
DLCO/ POP : valeur postopératoire prédite de la diffusion pulmonaire du monoxyde de carbone ; VEMS/POP : valeur postopératoire prédite du volume maximum expiré en 1 seconde ; VO2 max : consommation maximale d’oxygène (ml/kg/min) ; VT : valeur théorique.
Figure 5 : Algorithme de l’American Collège of Chest Physicians) [21].
Évaluation du risque cardio-vasculaire
Pour une pneumonectomie, les maladies cardio-vasculaires et l’âge sont les principaux facteurs de risque pour une complication cardio-pulmonaire [22]. L’évaluation du risque cardiologique est donc indispensable et bien codifiée [23]. Le bilan cardiologique minimum devrait comprendre une anamnèse des facteurs de risque et un ECG. Le bilan doit également rechercher d’autres comorbidités telles qu’anévrismes aortiques, sténoses carotidiennes, cirrhose hépatique, anémie préopératoire.
7. Conclusion
Le cancer bronchique est un cancer fréquent et de mauvais pronostic dont le diagnostic à un stade précoce, associé à une résection chirurgicale carcinologique complète, offre les meilleures chances de guérison. Un bilan d’extension et fonctionnel de qualité sont donc essentiels pour une sélection optimale des patients opérables. Le scanner est l’examen de première intention permettant d’identifier les stades métastatiques évidents ou les envahissements ganglionnaires massifs. Dans les autres cas, le TEP-scanner a un rôle essentiel pour le bilan d’extension ganglionnaire et métastatique, cerveau exclus. La stadification repose actuellement sur la 8ème édition de la classification TNM qui met l’accent sur l’importance de la taille de la tumeur, ainsi que sur le caractère particulier des tumeurs oligo-métastatiques de meilleur pronostic. Le rôle du TEP-TDM est fondamental dès lors que la tumeur n’apparait pas d’emblée métastatique sur le scanner. Toute adénopathie ou masse périphérique hypermétabolique doit être prélevée pour analyse histologique si leur confirmation tumorale modifie la prise en charge thérapeutique.
Liens d’intérêts : L’auteure déclare ne pas avoir de liens d’intérêts en rapport avec cet article.
Références
- Freddie Bray, et al Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries .Ca Cancer J Clin 2018;68:394 424
- Registre des cancers d’Alger 2015INSP
- Dela Cruz CS, Tanoue LT, Matthay RA. Lung cancer: epidemiology, etiology, and prevention. Clin Chest Med 2011 ;32 : 605–44.
- Cancer du poumon, Bilan initial. Collection Recommandations et référentiels, ouvrage collectif édité par l’INCa, Boulogne- Billancourt, juin 2011.
- Jouneau, M. Kerjouan, R. Corre, P. Delaval, B. Desrues. Sémiologie des maladies respiratoires EMC – Pneumologie 1Volume 12 > n◦2 > avril 2015
- Tomiyama N, Mihara N, Maeda M, et al. CT-Guided biopsy of small pulmonary nodules: value of respiratory gating. Radiology 2000;217: 907- 910.
- Jeanbourquin D, Bensalah J, Duong K, Foerenbach H, Arnaud FX, Padovani B, et al. Chapitre 6. Pathologie tumorale du parenchyme pulmonaire. 2013.
- Ost DE, Yeung SC, Tanoue LT, Gould MK. Clinical and organizational factors in the initial evaluation of patients with lung cancer: Diagnosis and management of lung cancer, 3rd Ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013;143: e121S-41S.
- Baaklini WA, et al. Diagnostic yield of fiberoptic bronchoscopy in evaluating solitary pulmonary nodules. Chest2000; 117:1049-54.
- Cancer du poumon, Bilan initial. Collection Recommandations et référentiels, ouvrage collectif édité par l’INCa, Boulogne- Billancourt, juin 2011.
- Pieterman RM, Van Putten. Preoperative staging of non-small lung cancer with positron emission tomography. N Engl J Med 2000;343: 254- 261.
- Gould MK, Maclean CC, Kuschner WG, Rydzak CE, Owens DK. Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions: a meta-analysis. JAMA 2001; 285:914–24. Fletcher JW. A comparison of the diagnostic accuracy of 18F-FDG PET and CT in the characterization of solitary pulmonary nodules. J Nucl Med 2008; 49:179–85
- Deppen S, Putnam Jr JB, Andrade G, Speroff T, Nesbitt JC, Lambright ES, et al. Accuracy of FDG-PET to diagnose lung cancer in a region of endemic granulomatous disease. Ann Thorac Surg 2011; 92:428–32
- Zhuang H, Yu JQ, Alavi A. Applications of fluorodeoxyglucose-PET imaging in the detection of infection and inflammation and other benign disorders. Radiol Clin North Am 2005; 43:121–34.
- Recommandations INCa-SPLF sur le bilan initial d’un cancer du poumon. Rev Mal Respir. Actu 2011 ;3 :280-4.
- Dietel M, Bubendorf L, et al. Diagnostic procedures for non-small cell lung cancer (NSCLC): recommendations of the European Expert Group. Thorax. Févr 2016; 71(2): 177‑
- Recommandations nationales INCa-SPLF sur le bilan initial d’un cancer du poumon. Rev Mal Respir Actu 2011;3:280-4.
- Rivera MP, Mehta AC, Wahidi MM. Establishing the diagnosis of lung cancer 3rd ed. American college of chest physicians evidence-based clinical practice guidelines. Chest 2013; 143: e142s-65s.
- Cancer du poumon, Bilan initial [Internet]. INCa; 2011 juin [cité 19 déc 2014]. (Recommandations et référentiels). Disponible sur: undefined
- Dans: Amin MB, Edge SB, Greene FL, et al., Éd.: AJCC Cancer Staging Manual. 8e éd. New York, NY: Springer, 2017, p. 431–5
- Brunelli A, Kim AW, Berger KI, Addrizzo-Harris DJ. Physiologic evaluation of the patient with lung cancer being considered for resectional surgery: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013 May;143(5 Suppl):e166S–e190S.
- Bernard A, Deschamps C, Allen MS, Miller DL, Trastek VF, Jenkins GD, Pairolero PC : Pneumonectomy for malignant disease: Factors affecting early morbidity. J Thorac Cardiovasc Surg2001 ; 121 : 1076-82.
- David C. Goff, JR, et al. Guideline on the Assessment of Cardiovascular Risk Journal of the American College of Cardiology. Vol. 63, No. 25, 2014
Télécharger le PDF de cet article